Mónica Rojo
Técnica Responsable de Información Médica y Documentación Científica
Grünenthal Pharma, S. A.
Elena Guardiola
Unidad de Información y Documentación Médica
Bayer Hispania, S. L.
En representación del Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España (AMIFE)
Resumen
Objetivo: a falta de una legislación específica, el Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España se planteó la importancia de definir y orientar las obligaciones y actividades de información médica en la industria farmacéutica. Aunque existen algunas guías internacionales, se consideró imprescindible elaborar una guía española de buenas prácticas para empresas y profesionales, y compartir al mismo tiempo con la comunidad médica, los pacientes y el público en general los estándares de calidad que rigen la información médica en la industria farmacéutica.
Metodología: durante una reunión ordinaria, se invitó a los miembros a participar en el proyecto, ya fuera en la planificación, redacción, revisión por pares o edición de los capítulos; de entre ellos, se eligió a dos coordinadores. Se consensuaron los temas que debían tratarse y se estableció la estructura de los capítulos. Cada capítulo debía incluir una revisión exhaustiva del tema y observaciones o conclusiones que darían lugar a las recomendaciones finales. Tras establecerse un índice inicial, se solicitaron autores voluntarios para la redacción; se eligieron según su experiencia y campo principal de interés. Cuando se dispuso de los capítulos redactados, los coordinadores designaron a dos miembros del grupo de trabajo para la revisión de cada capítulo, con el fin de detectar carencias o errores de contenido y forma. Los coordinadores realizaron una segunda revisión para asegurar la consistencia de la obra, extrajeron las conclusiones y recomendaciones, las sometieron a revisión y votación de los miembros del grupo de trabajo y llevaron a cabo la edición final de los textos.
Resultados: se redactó la Guía de buenas prácticas de información médica en la industria farmacéutica española. En sus doce capítulos se revisaron la función e importancia de la información médica, las características y actividades de los departamentos de información médica, la formación y cualificación de sus profesionales y los procedimientos normalizados de trabajo, así como el marco legal y ético en el que se mueve, la legislación sobre propiedad intelectual, el papel de la medicina basada en la evidencia, la importancia de la evaluación de la calidad y los retos de la información médica de cara al futuro. Se consensuaron quince recomendaciones o conclusiones.
Resum
Objectiu: a manca d’una legislació específica, el Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España es va plantejar la importància de definir i orientar les obligacions i les activitats d’informació mèdica en la indústria farmacèutica. Tot i que hi ha algunes guies internacionals, es va considerar imprescindible elaborar una guia espanyola de bones pràctiques per a empreses i professionals, i alhora compartir amb la comunitat mèdica, els pacients i el públic en general els estàndards de qualitat que regeixen la informació mèdica en la indústria farmacèutica.
Metodologia: durant una reunió ordinària, es van convidar els membres a participar en el projecte, fos en la planificació, la redacció, l’avaluació d’experts o l’edició dels capítols; d’entre els membres, es van triar dos coordinadors. Es van consensuar els temes que s’havien d’abordar i es va establir l’estructura dels capítols. Cada capítol havia d’incloure una revisió exhaustiva del tema i observacions o conclusions, que donarien lloc a les recomanacions finals. Després d’establir un índex inicial, es van sol·licitar autors voluntaris per fer-ne la redacció, i es van triar d’acord amb la seva experiència i el seu camp principal d’interès. Quan es va disposar dels capítols redactats, els coordinadors van designar dos membres del grup de treball per fer la revisió de cada capítol, amb la finalitat de detectar-hi mancances o errors de contingut i forma. Els coordinadors van fer una segona revisió per assegurar la consistència de l’obra, en van extreure les conclusions i les recomanacions, les van sotmetre a la revisió i la votació dels membres del grup de treball i van fer l’edició final dels textos.
Resultats: es va redactar la Guía de buenas prácticas de información médica en la industria farmacéutica española. En els dotze capítols que la formen es van revisar la funció i la importància de la informació mèdica, les característiques i les activitats dels departaments d’informació mèdica, la formació i la qualificació dels seus professionals i els procediments normalitzats de treball, com també el marc legal i ètic en què es mou, la legislació sobre propietat intel·lectual, el paper de la medicina basada en l’evidència, la importància de l’avaluació de la qualitat, i els reptes de la informació mèdica amb vista al futur. Es van consensuar quinze recomanacions o conclusions.
Abstract
Objectives: In the absence of specific legislation, the Work Group on Medicines Information of the Medicines Association of the Spanish Pharmaceutical Industry (Asociación de Medicina de la Industria Farmacéutica, AMIFE) decided to define and delimit the obligations involved in managing medicines information in the pharmaceutical industry. Although certain international guides are currently available, it was considered necessary to write a Spanish guide that could be used by pharmaceutical companies and professionals and whose demands for quality standards in the sector could also be shared with the medical community, patients and the public at large.
Methodology: In the course of one of the Group’s regular meetings, group members were invited to participate in one of the project areas, which were the planning, write-up, evaluation of experts and publication of the guide in chapters. After choosing two project coordinators, the members agreed on the subjects to be covered and established the structure for the chapters. It was decided that each chapter should include a comprehensive review of a subject and observations or conclusions that would form the basis for a series of recommendations After drafting an initial table of contents, the group invited a series of professionals to work as voluntary authors, selecting these on the basis of their experience and main field of interest. When the authors had completed the first draft of the chapters, the Group coordinators appointed two members of the group to review each chapter and check it for missing information or errors of content or form. The coordinators then reviewed the chapters themselves to ensure the consistency of the overall guide and drew up conclusions and recommendations that were reviewed by the rest of the group and voted in or out of the final document.
Results: The result was the Guía de buenas prácticas de información médica en la industria farmacéutica española. The twelve chapters comprising the guide reviewed the functions and importance of medicines information, the features and activities of the different areas of medicines information, the training and qualification frameworks of medicines information professionals, standard work procedures and the legal and ethical frameworks informing these, legislation on intellectual property rights, the importance of the role of evidence-based medicine and of quality assurance and the challenges that medicines information will have to face in the future. Fifteen conclusions or recommendations were also made at the end of the document.
1 Introducción
La industria farmacéutica (IF), como sector de investigación, innovación y desarrollo, ha sufrido en las últimas décadas una enorme transformación científica y tecnológica, en la que sigue inmersa hoy en día. Como resultado, ha tenido que adaptarse constante y rápidamente a un entorno cambiante y también desafiante. En este contexto, tanto los profesionales de la salud como los usuarios y los pacientes, ávidos de información médica (IM) y científica, utilizan tecnología cada vez más sofisticada para buscar todo aquello que les pueda interesar en relación con el cuidado de su salud y, muy especialmente, con el tratamiento de la enfermedad.
La constante renovación tecnológica produce una relación y una interacción muy rápidas en temas de salud, en las que participan diversos actores en distintos niveles. Es aquí donde los departamentos de IM han desempeñado y desempeñan un papel fundamental en la evolución y la adaptación de la IF al nuevo entorno tecnológico (Giffin; Baumeister; Bowers, 2014). Así, los departamentos de IM desempeñan un papel primordial en la provisión de información médico-científica objetiva y actualizada a profesionales de la salud, pacientes y consumidores mediante diversos canales de comunicación. Desde la IF, los especialistas en IM proporcionan información sobre fármacos equilibrada y basada en la evidencia, que, en muchas ocasiones, constituye un apoyo fundamental para los profesionales de la salud en la toma de decisiones terapéuticas, con la finalidad de procurar la mejor atención al paciente y el uso adecuado de los fármacos (Fung et al., 2015).
Los departamentos de IM han evolucionado al mismo tiempo que lo ha hecho la IF, lo que ha supuesto un incremento en la demanda de respuestas en tiempo real o con tiempos de respuesta mucho más rápidos que anteriormente. Además, el uso generalizado de Internet (páginas web, redes sociales, etc.) ha incrementado el volumen de consultas que reciben los departamentos de IM, al mismo tiempo que han cambiado las características de los solicitantes: por un lado, la información obtenida previamente por Internet genera consultas más complejas; por otro, los profesionales de la salud y los pacientes esperan respuestas que sintonicen en fondo y forma con esta nueva realidad. Como consecuencia, la IF juega un papel cada vez mayor en la formación o educación de los profesionales de la salud y de los pacientes, por lo que las empresas deben contar con departamentos de IM dotados adecuadamente de recursos, que puedan adaptarse a los nuevos medios y canales de comunicación y transmisión de la información y que cuenten con el soporte apropiado para proporcionar información de manera precisa, consistente y adecuada que responda a las demandas de información científica de sus clientes (Fung et al., 2016; Rojo; Fragoso, 2017).
La comunicación, la documentación y la IM en la IF han ido avanzando progresivamente en las últimas décadas, en paralelo a los avances en las tecnologías de la información. Así, desde principios de los años ochenta del siglo pasado, la IM se convirtió en una función con entidad propia, a medida que aumentaba la demanda de información sistemática y organizada y que la complejidad de las preguntas requería respuestas más profundas y elaboradas. La forma de proporcionar respuestas a las consultas médico-científicas y de comunicar la información al consultante o usuario final se ha transformado, y los canales más utilizados están muy lejos de las vías habituales hasta hace pocos años. En este escenario, la relevancia de la función de la IM en la IF dependerá no solo de su adaptación a las nuevas y cambiantes tecnologías, sino también de su capacidad de proporcionar valor añadido tanto a clientes internos (de la propia empresa) como externos.
Los primeros departamentos de IM que surgieron en la IF respondían mayoritariamente a las preguntas de médicos y farmacéuticos sobre los productos de la compañía: composición, estabilidad, dosificación, administración, indicaciones aprobadas y usos fuera de indicación. Actualmente, los profesionales que forman parte de estos departamentos responden también a consultas de mayor complejidad sobre mecanismos de acción, farmacocinética, farmacodinamia, etc., lo que a menudo requiere de una investigación adicional, mayor tiempo de respuesta, profesionales expertos en productos o áreas terapéuticas concretos y recursos tecnológicos adecuados para la gestión y el archivo de la IM. Además, este entorno nuevo ha permitido que los profesionales de la IM pudieran involucrarse también en otras tareas científicas, con lo que han aportado valor añadido a la actividad de la empresa.
Hoy en día, las compañías disponen de sistemas de IM que permiten actualizaciones rápidas y eficientes y constituyen un punto de contacto único para el profesional de la IM dentro de la IF. Estos sistemas permiten registrar y realizar un seguimiento de las consultas y de las respuestas, recuperar datos y redactar y enviar cartas y documentos de respuesta a los consultantes. En cuanto a las consultas, estas se reciben mayoritariamente por teléfono y por correo electrónico, a través de las páginas web corporativas y mediante sistemas internos de comunicación con la red de ventas y otros departamentos de la empresa. Todas estas mejoras tecnológicas, así como la rápida conectividad, proporcionan a los profesionales de la IM una oportunidad sin precedentes para ampliar su papel en la comunicación de información médico-científica sobre seguridad y eficacia de los fármacos, a fin de facilitar el uso adecuado de estos (Fierro et al., 2009).
Es obvio que los profesionales de la salud, así como los pacientes y consumidores, disponen de innumerables medios para acceder y recuperar IM sin que esta proceda de la IF (por ejemplo, PubMed, Google, Wikipedia, páginas web sobre salud en Internet, etc.). Los pacientes se convierten así en expertos en sus propias enfermedades; pero la calidad de la información disponible en la red no siempre está contrastada y la confianza en estos contenidos es cuestionable (y puede ser incluso peligrosa): información incompleta o incorrecta, usada fuera de contexto o sin tener en cuenta las características particulares de cada paciente. A pesar de este acceso tan masivo a la información, los profesionales de la salud y los pacientes o consumidores han seguido haciendo, e incluso las han incrementado, consultas médicas a la IF; y son los departamentos de IM los encargados de responderlas. Actualmente, tal como afirman Fierro y colaboradores (2009), el profesional de IM ya no es un simple buscador de información en bases de datos que envía esa información al cliente: ahora es un profesional tecnológicamente eficiente que filtra y analiza grandes cantidades de información y de datos, con acceso a múltiples bases de datos, sitios web e informes internos; compila y analiza los datos más actuales y la información más relevante y científicamente válida, relacionada con un fármaco o una enfermedad, utilizando para ello las últimas tecnologías; elabora documentos de respuesta y dirige esta información de manera eficiente al cliente (profesional de la salud, paciente, etc.) de la manera más adecuada, según el caso (Rojo; Fragoso, 2017).
2 Deontología profesional en información médica
Toda profesión, y por ende todo profesional, requiere un marco normativo en el que plasmar de forma práctica la ética que rige su actividad, por lo que los colectivos profesionales sienten la necesidad de establecer unas normas específicas que definan los derechos y deberes bajo los que desarrollar su trabajo, con garantía para sí mismos y para los otros. Es ahí donde se enmarca la deontología profesional que, según la definición de Efrén Vázquez (2011), es «el conjunto de reglas, normas, principios, presuposiciones y actitudes que regulan el ejercicio de una determinada profesión» y que a menudo superan el marco del mero cumplimiento de la ley. Y son las asociaciones y colegios profesionales los encargados de plasmar esta necesaria reflexión ética en un conjunto normativo que da en llamarse código deontológico, guía de buenas prácticas, código de conducta, etc.
Haciendo un repaso somero de la situación europea, fue a principios de la década de 1970 cuando los técnicos de información de la IF del Reino Unido se hicieron conscientes de la necesidad de intercambiar ideas y experiencias que fomentaran su desarrollo profesional y se organizaron en la Pharmaceutical Information and Pharmacovigilance Association (PIPA). Esta asociación representa hoy a más de ochocientos miembros que trabajan en gran variedad de funciones de gestión de la información en la IF, tales como la IM, la farmacovigilancia, la información de la investigación científica y la información comercial. Un número creciente de miembros provienen de compañías de fuera del Reino Unido, así como de agencias, empresas consultoras y proveedores de servicios. La primera versión de su UK guidelines for the pharmaceutical industry medical information departments (Pharmaceutical Information and Pharmacovigilance Association, 2015) fue aprobada en 1995, y la actualización actualmente en vigor tiene fecha de 2013. De gran exhaustividad, hace un recorrido por todas las áreas, procesos, actividades y actores involucrados en la IM.
En España, la reflexión ética y deontológica sobre la recuperación y difusión de información se ha movido principalmente en torno a la biblioteca pública y los centros de documentación. En lo que se refiere a la aparición de códigos propios de asociaciones profesionales, la Asociación Multisectorial de la Información (ASEDIE) publicó en 1999 el Código ético del sector de servicios de información electrónica (Asociación Multisectorial de la Información, 2001) y en 2006 vio la luz el Codi deontològic del Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya (Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya, 2006). Ambos son considerados los primeros instrumentos deontológicos españoles verdaderamente profesionales y, como novedad, el código catalán recoge por primera vez en España la creación de una comisión deontológica dentro de la estructura del Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya.
En lo que se refiere al ámbito empresarial, el código ético más influyente en la IF europea es sin duda el EFPIA code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals de la European Federation of Pharmaceutical Industries and Associations (EFPIA). Este texto abarca la promoción de medicamentos sujetos a receta médica para profesionales sanitarios, así como las interacciones de estos con las compañías farmacéuticas. Comúnmente conocido como EFPIA Health care professionals code (European Federation of Pharmaceutical Industries and Associations, 2014), exhorta a los miembros de la asociación no solo a cumplir con su código deontológico, sino también a establecer las estructuras y los procedimientos internos necesarios para garantizar su cumplimiento, la gestión de reclamaciones, la elaboración de códigos nacionales y la elaboración de informes anuales sobre su implantación, desarrollo y cumplimiento. Además, establece la existencia de un comité compuesto por representantes de las asociaciones nacionales, el cual monitorizará la adopción de los códigos locales, promoverá las buenas prácticas en las actividades empresariales y ayudará a los miembros a poner en práctica los principios éticos y deontológicos recogidos en el texto. Su última actualización (aprobada en junio de 2014) incluye un anexo titulado «Guidelines for Internet websites available to healthcare professionals, patients and the public in Europe», de especial interés en el actual contexto de globalización de la información favorecido por la generalización de Internet.
En España, la Asociación Española de la Industria Farmacéutica (Farmaindustria) suscribió ya en 1991 el texto elaborado por la EFPIA, y dos años después lo adaptó a las disposiciones introducidas por la Directiva 92/28/CEE, de 31 de marzo de 1992, sobre medicamentos de uso humano. Desde entonces, esta asociación empresarial ha ido analizando, revisando y poniendo al día su autorregulación ética y deontológica, con objeto de dar respuesta a cualquier cuestión que se pueda presentar y dando pautas de actuación y reglas claras y concretas que deben guiar la conducta de los laboratorios en su relación con los profesionales sanitarios. Nace así en 2002 el Código de buenas prácticas de la industria farmacéutica (Farmaindustria, 2016), cuya última actualización (aprobada en 2016) se fundamenta en tres áreas: la promoción de medicamentos de prescripción, la interrelación con los profesionales y organizaciones sanitarios, y la interrelación con las organizaciones de pacientes.
Existen otros códigos internacionales de interés para los profesionales de la comunicación en general y para los de la IM en particular, entre los que cabe destacar el Código de conduta de la brasileña Associação da Indústria Farmacêutica de Pesquisa (Interfarma) (Associação da Indústria Farmacêutica de Pesquisa, 2016), una entidad sectorial sin ánimo de lucro fundada en 1990 que representa a empresas e investigadores nacionales y extranjeros encargados de la innovación en salud en Brasil. Revisado y actualizado en 2016, se trata de un texto dinámico, riguroso y extremadamente práctico, cuyo objetivo primordial es abordar los principales aspectos de los departamentos de IM de la IF, así como unificar y alinear los criterios de respuesta a las preguntas científicas y espontáneas de la comunidad científica para permitir así una discusión actualizada y no sesgada entre la empresa y los profesionales de la salud.
Sin embargo, no existe hasta el momento un código deontológico español o guía de buenas prácticas que oriente la actividad de los servicios de IM de la IF.
3 Guía de buenas prácticas de información médica en la industria farmacéutica española. Antecedentes, justificación y método
La Asociación de Medicina de la Industria Farmacéutica en España (AMIFE), fundada en el año 1975, es una agrupación de carácter científico, sin ánimo de lucro, cuyos objetivos principales son la formación continua y el soporte documental para todos los que trabajan en el sector médico-farmacéutico. Como asociación profesional, AMIFE colabora y apoya a grupos de trabajo de distintas áreas médico-farmacéuticas, en los que da cabida a profesionales que trabajan tanto en el sector sanitario como en la IF. Uno de estos grupos de trabajo, nacido a finales de 2014, es el Grupo de Información Médica.
Formado actualmente por unos treinta miembros procedentes tanto de la IF como de empresas de servicios, este grupo surgió como respuesta a la necesidad de reivindicar la relevancia de las unidades de IM de la IF en España, y su objetivo principal es la creación de un foro continuado de debate acerca del futuro de la IM y de sus profesionales. Otros aspectos importantes de su trabajo son la evolución del perfil profesional, el desarrollo de sus competencias y el análisis de sus herramientas de trabajo, con el objetivo de asegurar la máxima eficiencia de los servicios de IM de la industria y el reconocimiento del valor añadido que aportan en el ámbito de la salud.
Una de las primeras cuestiones que se debatieron en las reuniones iniciales del grupo fue la falta de legislación específica sobre IM. De hecho, la IF es uno de los sectores más regulados: tanto en España como en el resto del mundo, la actividad farmacéutica está sometida a la intervención administrativa del Estado, que supervisa y asegura unas garantías y mínimos de calidad en los productos dirigidos a los ciudadanos. Sin embargo, frente a la extensa regulación a la que se enfrentan departamentos como los de farmacovigilancia, registros, fabricación, etc., los servicios de IM carecen de legislación exclusiva referente a su campo de actuación, de manera que los profesionales cuentan casi exclusivamente con su criterio y su experiencia a la hora de crear procedimientos de trabajo y herramientas que aseguren la calidad de su actividad.
En este contexto, el Grupo de Trabajo de Información Médica de AMIFE invitó a todos sus miembros a participar en la elaboración de una guía española de buenas prácticas en IM, ya fuera en la planificación del proyecto, la redacción de los textos, la revisión por pares o la edición de los capítulos. A continuación se nombraron dos coordinadores, se consensuaron los temas que debían tratarse y se estableció la estructura de los capítulos, de manera que cada uno debía incluir una revisión exhaustiva del tema y unas observaciones o conclusiones que, una vez aprobadas por todos los miembros del grupo, darían lugar a las recomendaciones finales. Tras establecerse un índice inicial (sujeto a modificaciones en caso necesario), se solicitaron voluntarios para la redacción, y se eligió de entre ellos a los autores según su experiencia y su campo principal de interés (por ejemplo, experiencia en temas relacionados con la legislación farmacéutica, especial interés y conocimientos en el campo de la propiedad intelectual, experiencia en la formación de equipos o en la redacción de procedimientos, etc.). Tan pronto estuvieron listas las primeras versiones de los capítulos, los coordinadores designaron a dos miembros del grupo de trabajo para la revisión por pares de cada capítulo, con el fin de detectar posibles carencias de los textos o errores de contenido y forma. Tras las correcciones posteriores por parte de los autores, los coordinadores llevaron a cabo una segunda revisión, con el fin de asegurar la consistencia de la obra; además, extrajeron de los capítulos las conclusiones y recomendaciones, las sometieron a revisión y votación de los miembros del grupo de trabajo y llevaron a cabo la edición final de los textos.
Así, han participado en este proyecto quince miembros del grupo, pertenecientes a catorce empresas distintas. Cada uno de los capítulos debía incluir la revisión y el análisis de un tema o aspecto específico de la profesión, así como una o varias observaciones o conclusiones finales que, una vez consensuadas con todos los miembros del grupo, darían lugar a un número inicialmente indeterminado de recomendaciones. Todos los capítulos fueron revisados por al menos cuatro expertos antes de ser aceptados para su publicación (Rojo et al., 2016; Guardiola et al., 2017). El resultado de este trabajo es la Guía de buenas prácticas de información médica en la industria farmacéutica española (Rojo; Fragoso, 2017), primera de estas características en España.
Dadas las particularidades de la información médico-científica que proporciona la IF, relacionada con fármacos y otros productos sanitarios y dirigida a profesionales de la salud y a pacientes (consumidores o usuarios), se consideró que era especialmente relevante abordar y profundizar en los aspectos relacionados con la ética y con el cumplimiento de las normas legales y de conducta (legislación vigente, códigos de conducta de la industria farmacéutica, etc.). Por este motivo, tres de los doce capítulos de la guía se dedicaron a revisar en profundidad estos temas: «Normativa española y europea sobre medicamentos y su aplicación a la información médica», «Ética y deontología profesional en información médica» y «La propiedad intelectual en el ámbito de la industria farmacéutica española: aspectos relacionados con la información médica».
Previa a la redacción del capítulo correspondiente de la guía, se realizó una revisión exhaustiva sobre ética y deontología en IM desde la IF, que quedó plasmada en un documento previo, «Deontología profesional en información médica en la industria farmacéutica: en el camino hacia un código español de buenas prácticas» (Rojo; Grupo de Trabajo de Información Médica de AMIFE, 2016).
Además, entre los doce capítulos que finalmente forman la guía (tabla 1) se prestó especial atención a la formación de los profesionales de la IM, a la necesidad de que las empresas cuenten con procedimientos normalizados de trabajo y a la gran importancia de realizar controles de calidad de la información proporcionada.
- Información médica: su importancia en la industria farmacéutica
- Normativa española y europea sobre medicamentos y su aplicación a la información médica
- Ética y deontología profesional en información médica
- Emisores y receptores de información: industria farmacéutica, empresas de servicios, autoridades sanitarias, profesionales sanitarios, ciudadanos y pacientes
- El departamento de información médica. Qué, quién y cómo
- Procedimiento normalizado de trabajo en información médica
- Profesionales de la información médica. Formación, funciones y competencias
- Herramientas y fuentes de información médica
- Medicina basada en la evidencia. Papel de la información médica en la toma de decisiones clínicas
- La propiedad intelectual en el ámbito de la industria farmacéutica española: aspectos relacionados con la información médica
- Indicadores, métricas y gestión de la calidad de información médica
- Retos de la información médica hoy: una mirada hacia el futuro
Tabla 1. Capítulos de la Guía de buenas prácticas de información médica en la industria farmacéutica española (Rojo; Fragoso, 2017)
4 Guía de buenas prácticas de información médica en la industria farmacéutica española. Conclusiones y recomendaciones
Tras el proceso de análisis y revisión realizado para llevar a cabo la guía, se redactaron las quince conclusiones o recomendaciones siguientes, consensuadas por todos los participantes en el proyecto.
- La información médica es una actividad necesaria para que los medicamentos y productos sanitarios comercializados por las compañías farmacéuticas se utilicen de forma segura y eficaz. Para ello, las empresas deben proporcionar información puntual, fiable, precisa, equilibrada e imparcial a profesionales sanitarios, pacientes y usuarios.
- A falta de legislación específica, es importante definir y orientar las obligaciones y actividades de información médica en la industria farmacéutica.
- Las asociaciones profesionales deben promover la redacción de códigos de buenas prácticas que guíen la actividad de los profesionales y garanticen la calidad, la equidad y el equilibrio de la información. Para conseguir un equilibrio entre deontología profesional y ética empresarial, se impulsará el cumplimiento de las guías nacionales e internacionales actualizadas.
- Las empresas farmacéuticas deben contar con departamentos de información médica formados por equipos multidisciplinares de expertos en medicamentos y en gestión de la información.
- Las empresas farmacéuticas tienen procedimientos normalizados de trabajo que guían la actividad de los departamentos de información médica y aseguran su calidad y eficacia. Estos deben reflejar la legislación y la normativa interna de la compañía, así como las del país en el que desarrollan su actividad.
- Los técnicos de información médica desempeñan un rol estratégico que proporciona información fiable, precisa, equilibrada e imparcial sobre los productos de la compañía a profesionales de la salud, administraciones públicas y pacientes o consumidores, colaborando en el uso seguro y eficaz de los medicamentos y productos sanitarios.
- La industria farmacéutica debe apostar por la formación técnico-científica y ética de los técnicos de información médica, con el fin de seguir aportando valor añadido a sus actividades. A su vez, los profesionales deben estar comprometidos con la calidad, el desarrollo y el aprovechamiento de la formación para garantizar el mejor servicio posible.
- El profesional de la información médica debe estar siempre actualizado en el conocimiento de las herramientas de búsqueda existentes y en sus funcionalidades. Asimismo, debe estar profundamente formado en las herramientas de gestión necesarias para el desarrollo de su trabajo, con el fin de sacarles el mayor y mejor partido posible.
- Como pilar de la medicina basada en la evidencia, la información médica proporcionada por la industria farmacéutica debe ser una herramienta objetiva y rigurosa que permita al profesional sanitario la mejor toma de decisión clínica posible, junto con su experiencia y las preferencias del paciente.
- La sistemática de trabajo recomendada en información médica debe basarse en el uso del formato PICO (para la formulación de la pregunta clínica) y la metodología GRADE (para la evaluación crítica de la información). En la búsqueda y recopilación de evidencias, se aconseja utilizar fuentes secundarias y específicas para la medicina basada en la evidencia (evidencias preevaluadas).
- Para el envío de documentos científicos, es aconsejable la utilización de reproducciones digitales (antes que reprográficas). Se recomienda la firma de una licencia de reproducción (general o puntual) con una entidad de gestión autorizada (p. ej. CEDRO) o de los correspondientes contratos con las editoriales.
- Las empresas implantarán indicadores y métricas que permitan controlar y valorar la calidad del servicio de información médica. Los datos obtenidos se utilizarán además para establecer planes de mejora, prevención de riesgos, formación, etc. Las métricas deberían ser cuantitativas y cualitativas, y se aconseja repetirlas periódicamente para asegurar en el tiempo la calidad de los procesos, su eficacia, su efectividad y el cumplimiento de los estándares establecidos.
- En el contexto de libre acceso a la información, es imprescindible que la industria farmacéutica se plantee la forma adecuada de atender las demandas de los pacientes, grandes consumidores de información médica y científica y cada vez más implicados en la toma de decisiones sobre su salud.
- Se recomienda una estrecha colaboración entre los sectores público y privado, con el objetivo común de beneficiar a la salud pública en general y al paciente en particular.
- El Grupo de Trabajo de Información Médica de AMIFE recomienda a los departamentos de información médica y a sus profesionales el conocimiento y seguimiento de esta guía de buenas prácticas. Asimismo, el grupo se compromete a revisar este texto y a realizar las actualizaciones que se consideren necesarias.
Tabla 2. Conclusiones y recomendaciones de la Guía de buenas prácticas de información médica en la industria farmacéutica española (Rojo; Fragoso, 2017)
La información médica es una actividad necesaria para que los medicamentos y productos sanitarios comercializados por las compañías farmacéuticas se utilicen de forma segura y eficaz. Para ello, las empresas deben proporcionar información puntual, fiable, precisa, equilibrada e imparcial a profesionales sanitarios, pacientes y usuarios.
Según datos extraídos de la encuesta realizada en 2014 por el Grupo de Trabajo de Información Médica de AMIFE (Flores et al., 2015; Guardiola et al., 2016), el 62,8 % de las 85 empresas farmacéuticas y biomédicas españolas que respondieron el cuestionario reciben de media más de 500 consultas y solicitudes anuales de IM. Entre las más frecuentes se encuentran preguntas técnicas relacionadas con la eficacia, la seguridad, la dosificación, la administración y los efectos adversos de los medicamentos, así como sobre posibles usos fuera de indicación, estabilidad y almacenamiento del producto (Flores et al., 2015; Guardiola et al., 2016) que, en muchas ocasiones, se encuentran únicamente en los archivos del fabricante. Resulta evidente que todos estos temas pueden repercutir directamente en el uso seguro de los fármacos por parte de los profesionales sanitarios y de los pacientes, por lo que es imprescindible que los departamentos de IM aseguren la alta calidad y la seguridad de la información que proporcionan.
A falta de legislación específica, es importante definir y orientar las obligaciones y actividades de información médica en la industria farmacéutica.
No existe en España ninguna ley que haga referencia específica a las obligaciones, responsabilidades o funciones de los servicios de IM de la IF. Tan solo se puede encontrar en algunos documentos la afirmación de la obligatoriedad de la existencia de este servicio de IM para los titulares de autorización de comercialización de fármacos. Así se especifica en el Real decreto 1416/1994, de 25 de junio, por el que se regula la publicidad de los medicamentos de uso humano (España, 1994). Sin embargo, en el resto del texto no se hace referencia alguna a otras actividades que, como la IM, queden fuera del concepto de promoción.
Según el código de Farmaindustria (Farmaindustria, 2016), estas son las otras actividades no promocionales que puede llevar a cabo una empresa farmacéutica, varias de las cuales pueden estar, en todo o en parte, dentro de las responsabilidades de los departamentos de IM:
- El etiquetado y prospecto de los medicamentos.
- La correspondencia, acompañada, en su caso, de cualquier documento no publicitario (por ejemplo, artículos científicos) necesario para responder a una pregunta concreta sobre un medicamento en particular, pero tan solo si se refiere a la cuestión objeto de consulta y es veraz y no engañosa.
- Las informaciones concretas y los documentos relativos, por ejemplo, al cambio de envase, a las advertencias sobre reacciones adversas en el marco de la farmacovigilancia, a los catálogos de ventas y a las listas de precios, siempre que no figure ninguna información sobre el medicamento. Tampoco cubre la información que el médico pueda facilitar al paciente en relación con determinados medicamentos que, por la complejidad de su posología, vía de administración, etc., requieran de la entrega de información adicional, y siempre que esta información tenga como objetivo mejorar el cumplimiento del tratamiento.
- La información sobre salud humana o enfermedades de las personas, siempre que no se haga referencia alguna, ni siquiera indirecta, a un medicamento.
Las asociaciones profesionales deben promover la redacción de códigos de buenas prácticas que guíen la actividad de los profesionales y garanticen la calidad, la equidad y el equilibrio de la información. Para conseguir un equilibrio entre deontología profesional y ética empresarial, se impulsará el cumplimiento de guías nacionales e internacionales actualizadas:
- Código de buenas prácticas de la industria Farmacéutica de Farmaindustria (Farmaindustria, 2016).
- UK Guidelines for the Pharmaceutical Industry Medical Information Departments (Guia de bones pràctiques de la PIPA): és un conjunt de normes accessibles i indicatives d’un nivell de qualitat elevat en els serveis d’informació mèdica de les empreses farmacèutiques (Pharmaceutical Information and Pharmacovigilance Association, 2015).
- Código de conducta para mediadores de información de la European Association of Information Services (EUSIDIC): recull exhaustivament els aspectes empresarials de les activitats relacionades amb la informació científica (European Association of Information Services, 1994).
Las empresas farmacéuticas deben contar con departamentos de información médica formados por equipos multidisciplinares de expertos en medicamentos y en gestión de la información.
El departamento de IM es aquel que se encarga de suministrar información precisa, actualizada y equilibrada sobre los medicamentos de la compañía en respuesta a peticiones espontáneas de los profesionales sanitarios, los pacientes y otras áreas de la compañía, como pueden ser el departamento médico, ventas, marketing, farmacovigilancia, registros, calidad o investigación y desarrollo. Para muchos médicos, farmacéuticos y otros profesionales sanitarios, este es el primer punto de contacto cuando necesitan información sobre los productos de una compañía; además, dicha información puede ser urgente y compleja, e incluso constituir la base para la gestión del tratamiento de un paciente. Esta es la razón por la que el profesional de IM debe tener, además de conocimientos acerca de los productos, habilidades para gestionar con profesionalidad las respuestas a los usuarios.
Las empresas farmacéuticas tienen procedimientos normalizados de trabajo que guían la actividad de los departamentos de información médica y aseguran su calidad y eficacia. Estos deben reflejar la legislación y la normativa interna de la compañía, así como las del país en el que desarrollan su actividad.
Como cualquier otra actividad de una empresa farmacéutica, el servicio de IM debe cumplir con ciertos parámetros de calidad, estandarización y transparencia, de manera que la información que se brinde sea certera, fiable, equilibrada y consistente. Para ello, dispone de procedimientos normalizados de trabajo: documentos que recogen de un modo detallado, exhaustivo, preciso y sin posibilidad de confusión la estructura, la organización y la metodología del servicio de forma clara y concisa, y describen paso a paso el trabajo diario. Estos procedimientos normalizados de trabajo se redactan en sintonía con las leyes y estándares nacionales e internacionales, y se apoyan en los principios y valores corporativos recogidos en las políticas de cada compañía. Son además documentos vivos, revisables, sujetos a modificaciones según las necesidades corporativas.
Por su parte, las empresas de servicios independientes que trabajan para la IF elaboran sus propios procedimientos, en los que detallan su labor diaria en sintonía con la normativa local y europea y, normalmente, también con las políticas de las compañías a las que brindan el servicio de IM.
Los técnicos de información médica desempeñan un rol estratégico que proporciona información fiable, precisa, equilibrada e imparcial sobre los productos de la compañía a profesionales de la salud, administraciones públicas y pacientes o consumidores, colaborando en el uso seguro y eficaz de los medicamentos y productos sanitarios.
El servicio de IM es un servicio orientado al cliente que ayuda a mejorar el uso seguro y eficaz de los productos de la compañía. Así, la función principal de los técnicos de información médica es proporcionar información basada en la evidencia de forma puntual, precisa e imparcial a los profesionales de la salud, consumidores o pacientes, para asegurar el uso apropiado de los productos de la compañía. Por otro lado, se revelan como un rol estratégico y una gran fuente de información para la compañía, ya que pueden proporcionar datos o consideraciones importantes sobre el cliente que se pueden incorporar a los planes del ciclo del producto y otras actividades relevantes.
Según datos extraídos de la ya mencionada encuesta del grupo de trabajo de AMIFE (Flores et al., 2015; Guardiola et al., 2016), entre sus principales actividades se encuentran el manejo de consultas de información sobre medicamentos, la elaboración de respuestas estándares, la realización de búsquedas bibliográficas y el desarrollo y mantenimiento de conocimientos científicos actualizados sobre productos de la compañía y áreas terapéuticas relevantes.
La industria farmacéutica debe apostar por la formación técnico-científica y ética de los técnicos de información médica, con el fin de seguir aportando valor añadido a sus actividades. A su vez, los profesionales deben estar comprometidos con la calidad, el desarrollo y el aprovechamiento de la formación para garantizar el mejor servicio posible.
Dado el gran número de competencias científicas, analíticas, éticas, técnicas y comunicativas que los técnicos de información médica deben desarrollar para el adecuado desempeño de su labor, es fundamental que las empresas cuenten con un programa de educación continua que vaya más allá de los contenidos concretos de la IM. Entre las áreas de formación de mayor importancia cabe destacar no solo las relacionadas con los medicamentos, productos sanitarios y áreas terapéuticas propias del negocio y de su área de especialización, sino también otras competencias referidas a la ética profesional y empresarial, la gestión de equipos, la planificación estratégica, la relación con el cliente, etc.
Por su parte, los profesionales de la IM deben poner el mayor empeño en el aprovechamiento de dicha formación, ya que de ella se derivan el perfeccionamiento constante de su actividad laboral y el mantenimiento de su compromiso con su empresa, los profesionales sanitarios y los pacientes que, en última instancia, se benefician de los servicios de IM de la IF.
El profesional de la información médica debe estar siempre actualizado en el conocimiento de las herramientas de búsqueda existentes y en sus funcionalidades. Asimismo, debe estar profundamente formado en las herramientas de gestión necesarias para el desarrollo de su trabajo, con el fin de sacarles el mayor y mejor partido posible.
Desde el nacimiento de Internet en los años setenta del siglo pasado, pero sobre todo en las últimas décadas, el trabajo diario de los profesionales de la IM se ha visto profundamente modificado a causa de las nuevas tecnologías, el crecimiento exponencial de la información científico-técnica disponible y la existencia de una cantidad de fuentes y herramientas prácticamente inabarcable. Por su parte, estas herramientas han evolucionado considerablemente y se han convertido en más amigables y fáciles de usar. Sin embargo, para hacer una búsqueda realmente eficaz se requieren conocimientos y experiencia que, en muchos casos, solo los técnicos de información médica han adquirido a lo largo de años de trabajo y de formación específica.
Como hemos comentado con anterioridad, el objetivo último del técnico de información médica es proporcionar una información objetiva y de calidad tanto a profesionales sanitarios como a pacientes; para ello, utilizará todas las herramientas a su alcance. El técnico de información médica no solo ha de conocer los instrumentos técnicos propios de su actividad y saber sacarles el máximo provecho, sino que tendrá que actualizarse continuamente sobre las novedades que puedan surgir. Además, no solo es importante que sepa manejar las fuentes de información, sino que ha de tener la capacidad crítica adecuada para poder valorar la información que recupera y que, finalmente, suministra.
Como pilar de la medicina basada en la evidencia, la información médica proporcionada por la industria farmacéutica debe ser una herramienta objetiva y rigurosa que permita al profesional sanitario la mejor toma de decisión clínica posible, junto con su experiencia y las preferencias del paciente.
La medicina basada en la evidencia consiste en la toma de decisiones para resolver problemas clínicos de pacientes individuales, teniendo en cuenta no solo la evaluación sistemática de las mejores evidencias actuales, sino también la experiencia del clínico y las preferencias del propio paciente. Así, la medicina basada en la evidencia correctamente utilizada no debe reducirse solo a la lectura de publicaciones y evidencias en revistas biomédicas, sino que debe enfocarse en sus objetivos principales y su motivación más importante: la mejora de la calidad de la atención sanitaria, en el sentido de la búsqueda de intervenciones y prácticas que funcionan, así como la eliminación de aquellas que son ineficaces o perjudiciales para el paciente.
Uno de los puntos claves de la medicina basada en la evidencia es la actualización de las evidencias: la que hoy se considera mejor práctica puede cambiar o incluso ser desechada al mes o al año siguiente, lo que obliga a la ardua pero necesaria tarea de mantenerse al día. Para facilitar esta actualización, el profesional sanitario tiene a su disposición varias herramientas y fuentes de información, entre las que los departamentos de IM de la IF son un importante proveedor de evidencias científicas externas, uno de los pilares de la medicina basada en la evidencia para la toma de decisiones clínicas.
La sistemática de trabajo recomendada en información médica debe basarse en el uso del formato PICO (para la formulación de la pregunta clínica) y la metodología GRADE (para la evaluación crítica de la información). En la búsqueda y recopilación de evidencias, se aconseja utilizar fuentes secundarias y específicas para la medicina basada en la evidencia (evidencias preevaluadas).
Una de las herramientas más utilizadas a la hora de aplicar la medicina basada en la evidencia en la práctica clínica es la llamada metodología de los cinco pasos (Sackett et al., 2000): formulación de la pregunta clínica, búsqueda de la mejor evidencia, evaluación crítica de la evidencia, aplicación de la evidencia a los pacientes y autoevaluación (figura 1):
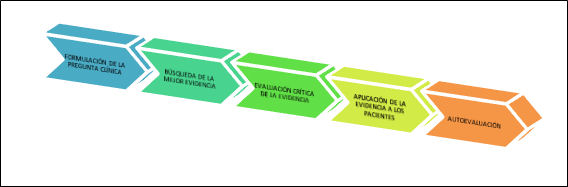
Figura 1. Esquema de los cinco pasos en medicina basada en la evidencia
Las preguntas se generan por cuestiones clínicas y están generalmente relacionadas con el diagnóstico, la etiología, el pronóstico, el tratamiento o la prevención.
Una pregunta bien construida debería tener cuatro componentes que se identifican con el acrónimo PICO:
- P (population): paciente o grupo de pacientes con una condición o enfermedad concreta (determina las características del paciente para delimitar la búsqueda).
- I (intervention): intervención objeto de la pregunta (terapéutica, preventiva, diagnóstica o pronóstica).
- C (comparison): intervención alternativa comparativa, si está disponible.
- O (outcome):resultado esperado o consecuencias de la intervención de interés.
Mientras que las fuentes primarias son, sobre todo, publicaciones procedentes de revistas biomédicas recopiladas por buscadores y bases de datos bibliográficas, las fuentes secundarias contienen información «prefiltrada» o «preevaluada», que facilita la recuperación de evidencias. Entre ellas, cabe destacar los metaanálisis, las revisiones sistemáticas, las guías de práctica clínica y los informes de evaluación de tecnologías (Health Technology Assessment – HTA). Algunos de estos documentos están específicamente enfocados a la obtención de información para la aplicación de la metodología de la medicina basada en la evidencia.
Para el envío de documentos científicos, es aconsejable la utilización de reproducciones digitales (antes que reprográficas). Se recomienda la firma de una licencia de reproducción (general o puntual) con una entidad de gestión autorizada (p. ej. CEDRO) o de los correspondientes contratos con las editoriales.
Dada la evolución tecnológica y la llegada masiva de los formatos digitales, el uso de fotocopias de libros y revistas ha dejado de ser útil y eficiente tanto en la IM como en el mundo de la información y la documentación en general. Además, el formato digital permite el almacenamiento masivo y facilita el rápido acceso a la información, así como la posibilidad de hacer un uso casi inmediato de ella y de aplicarla rápidamente a la práctica clínica si fuera necesario.
Como no puede ser de otra manera, la información que manejan diariamente los técnicos de información médica está sujeta a la legislación nacional e internacional sobre propiedad intelectual, que detalla qué se puede hacer y qué no con una obra, en qué condiciones concretas se puede utilizar y qué compensaciones han de recibir, en su caso, los propietarios de los derechos de autoría y explotación de una obra literaria, artística o científica. Dada la complejidad y el detalle de la ley, y puesto que el tiempo es un factor clave en la calidad de su servicio, es importante que los departamentos de IM cuenten con la ayuda de entidades especializadas y facultadas para gestionar los derechos de autor.
En España existen actualmente ocho entidades de gestión autorizadas por el Ministerio de Educación, Cultura y Deporte que representan a distintos grupos de propietarios de los derechos: autores y editores, artistas plásticos y audiovisuales, artistas, etc. En lo relacionado con la IM, el Centro Español de Derechos Reprográficos (CEDRO) representa a autores y editores de obras de texto (libros, publicaciones periódicas, partituras musicales), y su repertorio está formado por las obras de autores y editores de ámbito nacional e internacional, con convenios con más de treinta entidades homólogas extranjeras. En este sentido, CEDRO ofrece a los laboratorios farmacéuticos soluciones para el uso de contenidos protegidos por derechos de autor, con lo que posibilita su manejo para dar respuesta a consultas recibidas de profesionales sanitarios sobre sus productos. Esta licencia proporciona a los laboratorios farmacéuticos flexibilidad, agilidad en el desarrollo de sus actividades de IM y, sobre todo, el reconocimiento por parte de sus clientes, al ofrecer garantías de respeto al derecho de los autores y a la legislación vigente en materia de copyright.
Las empresas implantarán indicadores y métricas que permitan controlar y valorar la calidad del servicio de información médica. Los datos obtenidos se utilizarán además para establecer planes de mejora, prevención de riesgos, formación, etc. Las métricas deberían ser cuantitativas y cualitativas, y se aconseja repetirlas periódicamente para asegurar en el tiempo la calidad de los procesos, su eficacia, su efectividad y el cumplimiento de los estándares establecidos.
Garantizar la calidad de un producto o servicio para contribuir a su éxito conlleva la implementación de sistemas de gestión de calidad. Esa gestión implica una doble aproximación: por un lado, la aplicación de medidas destinadas a asegurar la calidad (aseguramiento por medio de la implementación de estándares de calidad) y, por otro, la aplicación de medidas destinadas a controlar dicha calidad (control del servicio prestado mediante auditorías internas y externas).
Los técnicos de información médica de la IF son responsables del desarrollo e implementación de métricas cuantitativas y cualitativas que permitan obtener estadísticas de la carga de trabajo y la calidad de las diferentes actividades que realizan (número de consultas respondidas, tiempos de respuesta, satisfacción del cliente, etc.). Además, estas métricas pueden ser usadas internamente en las empresas para detectar necesidades de formación o ajustes de personal, percepciones sobre clientes y autoridades, indicadores de rendimiento de la estrategia corporativa, etc.
En el contexto de libre acceso a la información, es imprescindible que la industria farmacéutica se plantee la forma adecuada de atender las demandas de los pacientes, grandes consumidores de información médica y científica y cada vez más implicados en la toma de decisiones sobre su salud.
Entre los variados retos a los que se enfrenta la IM de la IF, la información a pacientes es uno de los que más debate genera tanto en las propias empresas como en el ámbito general de la opinión pública.
Según la legislación actual, un paciente que solicite información a una empresa farmacéutica debe ser remitido a su médico, quien podría contactar con el servicio de IM para recibir los detalles con los que luego informar a su paciente. Pero, en la práctica, este círculo no suele cerrarse, por lo que la empresa que comercializa un fármaco no tiene oportunidad de compartir con el paciente, aunque sea de manera indirecta, información que podría ser relevante durante el consumo o uso de un determinado medicamento o producto farmacéutico. Además, la inmediatez que pueden requerir este tipo de consultas (relacionadas con la administración o la dosificación de fármacos, con el funcionamiento de los dispositivos, etc.) hace que la comunicación no siempre sea efectiva en condiciones reales. Sin embargo, los medios tecnológicos actuales nos pueden permitir establecer canales eficaces para hacer realidad este flujo, por lo que el reto se plantea para establecer los medios humanos y tecnológicos adecuados, con la colaboración de las administraciones sanitarias.
Por otro lado, las asociaciones de pacientes demandan activamente a las empresas farmacéuticas información para sus asociados, ya que juegan un papel activo en el fomento de la investigación y de la educación sanitaria. Los departamentos de IM podrían contribuir a satisfacer esta demanda, asegurando el establecimiento de los límites entre información y promoción —en España está prohibida la promoción directa a los pacientes de fármacos de prescripción— y facilitando los canales adecuados para la transmisión de esta información.
El paciente demanda tener cada vez más control sobre las decisiones acerca de su salud y para ello necesita estar informado. En este entorno, las autoridades sanitarias deben reflexionar sobre los límites de la información a pacientes, al tiempo que la IF debe iniciar el debate sobre su obligación legal y moral de proporcionar al paciente una información objetiva, equilibrada y no promocional sobre medicamentos y productos sanitarios.
Se recomienda una estrecha colaboración entre los sectores público y privado, con el objetivo común de beneficiar a la salud pública en general y al paciente en particular.
Los servicios de IM se enfrentan con retos numerosos y complejos. No es esta una situación nueva ni exclusiva, pero está en manos de los profesionales aceptar estos retos y convertirlos en oportunidades para crecer y mejorar. El gran objetivo es centrar los esfuerzos en proporcionar respuestas de calidad que contribuyan a un uso eficaz y seguro de los productos sanitarios, mediante los canales y en el formato preferido por los usuarios.
Al igual que en otros sectores industriales y empresariales, la colaboración en IM entre la Administración, la industria y otras entidades como la universidad redundaría, sin duda alguna, en el beneficio a corto, medio y largo plazo de la salud de los pacientes en particular y del sistema de salud en general. En manos de todos está poder sentar las bases de esa colaboración y ponerla en práctica.
El Grupo de Trabajo de Información Médica de AMIFE recomienda a los departamentos de información médica y a sus profesionales el conocimiento y seguimiento de esta guía de buenas prácticas. Asimismo, el grupo se compromete a revisar este texto y a realizar las actualizaciones que se consideren necesarias.
El Grupo de Trabajo de Información Médica de AMIFE considera que la Guía de buenas prácticas, es un instrumento que puede ser adecuado para su uso como referencia en los departamentos de IM y para sus profesionales. Por este motivo aconseja que aquellas personas que estén involucradas en IM desde la IF conozcan su contenido. Asimismo, y dado el cambio continuado que se produce en esta área, este grupo se compromete a revisar y actualizar el texto, total o parcialmente, cuando proceda, con el fin de que esta guía siga siendo útil tanto en la actualidad como en el futuro.
Bibliografía
Asociación Multisectorial de la Información (2001). «Código ético del sector de servicios de información electrónica». En: Domínguez Sánchez, Pilar; García de Paso, Esperanza (coord.). «Códigos de ética y deontología profesional. Selección, traducción y edición crítica». Boletín de la ANABAD, vol. 51, n.º 3, p. 135–145.
Associação da Indústria Farmacêutica de Pesquisa (2016). Código de conduta Interfarma. Revisão 2016. São Paulo, Brasil: Interfarma. <https://www.interfarma.org.br/public/files/biblioteca/105-codigoconduta2016bilinguesite.pdf>. [Consulta: 23/06/2017].
Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya (2006). Codi deontològic del Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya. Barcelona: Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya.
<http://www.cobdc.org/collegi/codi_deontologic.html>. [Consulta: 23/06/2017].
España (1994). «Real decreto 1416/1994, de 25 de junio, por el que se regula la publicidad de los medicamentos de uso humano». Boletín oficial del Estado, n.º 180 (29/07/1994), p. 24.404–24.410.
<https://www.boe.es/boe/dias/1994/07/29/pdfs/A24404-24410.pdf>. [Consulta: 23/06/2017].
European Association of Information Services (EUSIDIC) (1994). Código de conducta para mediadores de información. Madrid: Centro de Información y Documentación Científica (CINDOC), Doc6. <http://digital.csic.es/bitstream/10261/36897/1/CodigoDeontologico.pdf>. [Consulta: 02/12/2017].
European Federation of Pharmaceutical Industries and Associations (2014). EFPIA code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals. Final consolidated version 2013. Brussels: EFPIA. <http://transparency.efpia.eu/uploads/Modules/Documents/efpia-hcp-code-2014.pdf>. [Consulta: 23/06/2017].
Farmaindustria (2016). Código de buenas prácticas de la industria farmacéutica. Madrid: Farmaindustria.
<http://www.farmaindustria.es/web/wp-content/uploads/sites/2/2014/06/CBP_WEB_ESP.pdf>. [Consulta: 23/06/2017].
Fierro, Lesley; Savulich, Donna; Fraser, Charles; Gažo, Andrew; Wyble, Christine (2009). «Historical perspective of technologies used in medical communications. Past, present, and future». Drug information journal, vol. 43, p. 705–712.
Flores, Ángeles; Balmy, Sylvaine; Rojo, Mónica; Ortega, Patricia; Cabo, Lurdes; Carboneras, M.; del Cano, Marta; Escudero, Nuria; Fragoso, Jaime; García-Ortiz, Daniel; Iglesias, Inmaculada; Pozo, Tamara; Pulido, Fernanda; Rodríguez, Mónica; Sánchez-Navarro, María José; MI Working Group AMIFE (2015). «Descriptive
analysis of medical information departments within the pharmaceutical industry in Spain». European medical information and communications conference. London, 10–11 November 2015.
Fung, Stancey M.; Chang, Dannis Y.; Patel-Romero, Roshni; Suchodolski, Matt (2016). «Survey of health care practitioners’ preferences for medical information: collective insights for impacting patient care». Therapeutic innovation & regulatory science, vol. 50, no. 5, p. 569–576.
Giffin, Suzana A.; Baumeister, Peter; Bowers, David (2014). «Review of the evolution of medical information in light of changes in the external landscape». Therapeutic innovation & regulatory science, vol. 48, no. 6, p. NP6–NP14.
Guardiola, Elena; Flores, Ángeles; Balmy, Sylvaine; Rojo, Mónica; Ortega, Patricia; Cabo, Lurdes; del Cano, Marta; Escudero, Nuria; Fragoso, Jaime; García-Ortiz, Daniel; Iglesias, Inmaculada; Pozo, Tamara; Pulido, Fernanda; Rodríguez-Sangrador, Mónica; Sánchez-Navarro, María-José, on behalf of the AMIFE MI Working Group (2016). «Structure, organization and functions of medical information departments within the pharmaceutical industry in Spain: Results of a survey». 15th European Association for Health Information and Libraries (EAHIL) conference. Sevilla, 6–11 de junio de 2016. <https://www.researchgate.net/publication/305402990_Structure_organization_and_functions_of_Medical_
Information_departments_within_the_pharmaceutical_industry_in_spain_Results_of_a_survey>. [Consulta: 29/11/2017].
Guardiola, Elena; Fragoso, Jaime; Rojo, Mónica; Balmy, Sylvaine; Cabo, Lurdes; Díaz, Lourdes; Escudero, Nuria; Flores, Ángeles; García-Ortiz, Daniel; Hernández, M. Ángeles; Iglesias, Inmaculada; Ortega, Patricia; Pozo, Tamara; Pulido, Fernanda; Zabena, Carina; Grupo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España [AMIFE] (2017). «Elaboració de la primera Guia de Bones Pràctiques d’Informació Mèdica a la Indústria Farmacèutica Espanyola». ii Jornades de biblioteques i salut de Catalunya BCSalut 2017. Barcelona, 8 i 9 de juny de 2017. <https://scientiasalut.gencat.cat/handle/11351/2968>. [Consulta: 29/11/2017].
Medical Information Group (2015). Guide on medical information. São Paulo: Interfarma Associação da Indústria Farmacêutica de Pesquisa. <https://www.interfarma.org.br/public/files/biblioteca/72-guide-on-medical-information-site.pdf>. [Consulta: 23/06/2017].
Pharmaceutical Information and Pharmacovigilance Association (2015). UK guidelines for the pharmaceutical industry medical information departments. Haslemere, Surrey: PIPA. <http://www.pipaonline.org>. [Consulta: 10/05/2016].
Rojo, Mónica; Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica [AMIFE] (2016). «Deontología profesional en información médica en la industria farmacéutica: en el camino hacia un código español de buenas prácticas». Métodos de información, vol. 7, n.º 12, p. 43–68. <http://www.metodosdeinformacion.es/mei/index.php/mei/article/view/IIMEI7-N12-043068/902>. [Consulta: 29/11/2017].
Rojo, Mónica; Fragoso, Jaime (ed.) (2017). Guía de buenas prácticas de información médica en la industria farmacéutica española. Madrid: AMIFE. [En prensa].
Rojo, Mónica; Fragoso, Jaime; Balmy, Sylvaine; Cabo, Lurdes; del Cano, Marta; Díaz, Lourdes; Escudero, Nuria; Flores, Ángeles; García-Ortiz, Daniel; Guardiola, Elena; Iglesias, Inmaculada; López, Ana María; Martínez, Aitor; Ortega, Patricia; Pozo, Tamara; Pulido, Fernanda; Sánchez-Navarro, M. José; Zabena, Carina; del Foro de Información Médica de la Industria Farmacéutica (2016). «Primera guía española de buenas prácticas de información médica en la industria farmacéutica. Experiencia de trabajo». XII Jornadas APDIS. Investigação, inovação, intervenção. Coimbra, 20–22 de abril de 2016.
Sackett, David L.; Straus, Sharon E.; Richardson, W. Scott; Rosenberg, William; Haynes, R. Brian (2000). Evidence-based medicine: how to practice and teach EBM. (2nd ed.). Edinburgh: Churchill-Livingstone.
Vázquez, Efrén (2011). «Reflexiones sobre deontología judicial». En: Campos, F. G.; Cienfuegos, D.; Rodríguez, L. G.; Zaragoza, J. (coord.). Entre libertad y castigo: dilemas del estado contemporáneo. México D. F.: Universidad Nacional Autónoma de México, p. 837–843. <http://biblio.juridicas.unam.mx/libros/7/3104/50.pdf>. [Consulta: 23/06/2017].

 licencia de Creative Commons de tipo «
licencia de Creative Commons de tipo «