Mónica Rojo
Tècnica Responsable d’Informació Mèdica i Documentació Científica
Grünenthal Pharma, S. A.
Elena Guardiola
Unitat d’Informació i Documentació Mèdica
Bayer Hispania, S. L.
En representació del Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España (AMIFE)
Resum
Objectiu: a manca d’una legislació específica, el Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España es va plantejar la importància de definir i orientar les obligacions i les activitats d’informació mèdica en la indústria farmacèutica. Tot i que hi ha algunes guies internacionals, es va considerar imprescindible elaborar una guia espanyola de bones pràctiques per a empreses i professionals, i alhora compartir amb la comunitat mèdica, els pacients i el públic en general els estàndards de qualitat que regeixen la informació mèdica en la indústria farmacèutica.
Metodologia: durant una reunió ordinària, es van convidar els membres a participar en el projecte, fos en la planificació, la redacció, l’avaluació d’experts o l’edició dels capítols; d’entre els membres, es van triar dos coordinadors. Es van consensuar els temes que s’havien d’abordar i es va establir l’estructura dels capítols. Cada capítol havia d’incloure una revisió exhaustiva del tema i observacions o conclusions, que donarien lloc a les recomanacions finals. Després d’establir un índex inicial, es van sol·licitar autors voluntaris per fer-ne la redacció, i es van triar d’acord amb la seva experiència i el seu camp principal d’interès. Quan es va disposar dels capítols redactats, els coordinadors van designar dos membres del grup de treball per fer la revisió de cada capítol, amb la finalitat de detectar-hi mancances o errors de contingut i forma. Els coordinadors van fer una segona revisió per assegurar la consistència de l’obra, en van extreure les conclusions i les recomanacions, les van sotmetre a la revisió i la votació dels membres del grup de treball i van fer l’edició final dels textos.
Resultats: es va redactar la Guía de buenas prácticas de información médica en la industria farmacéutica española. En els dotze capítols que la formen es van revisar la funció i la importància de la informació mèdica, les característiques i les activitats dels departaments d’informació mèdica, la formació i la qualificació dels seus professionals i els procediments normalitzats de treball, com també el marc legal i ètic en què es mou, la legislació sobre propietat intel·lectual, el paper de la medicina basada en l’evidència, la importància de l’avaluació de la qualitat, i els reptes de la informació mèdica amb vista al futur. Es van consensuar quinze recomanacions o conclusions.
Resumen
Objetivo: a falta de una legislación específica, el Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España se planteó la importancia de definir y orientar las obligaciones y actividades de información médica en la industria farmacéutica. Aunque existen algunas guías internacionales, se consideró imprescindible elaborar una guía española de buenas prácticas para empresas y profesionales, y compartir al mismo tiempo con la comunidad médica, los pacientes y el público en general los estándares de calidad que rigen la información médica en la industria farmacéutica.
Metodología: durante una reunión ordinaria, se invitó a los miembros a participar en el proyecto, ya fuera en la planificación, redacción, revisión por pares o edición de los capítulos; de entre ellos, se eligió a dos coordinadores. Se consensuaron los temas que debían tratarse y se estableció la estructura de los capítulos. Cada capítulo debía incluir una revisión exhaustiva del tema y observaciones o conclusiones que darían lugar a las recomendaciones finales. Tras establecerse un índice inicial, se solicitaron autores voluntarios para la redacción; se eligieron según su experiencia y campo principal de interés. Cuando se dispuso de los capítulos redactados, los coordinadores designaron a dos miembros del grupo de trabajo para la revisión de cada capítulo, con el fin de detectar carencias o errores de contenido y forma. Los coordinadores realizaron una segunda revisión para asegurar la consistencia de la obra, extrajeron las conclusiones y recomendaciones, las sometieron a revisión y votación de los miembros del grupo de trabajo y llevaron a cabo la edición final de los textos.
Resultados: se redactó la Guía de buenas prácticas de información médica en la industria farmacéutica española. En sus doce capítulos se revisaron la función e importancia de la información médica, las características y actividades de los departamentos de información médica, la formación y cualificación de sus profesionales y los procedimientos normalizados de trabajo, así como el marco legal y ético en el que se mueve, la legislación sobre propiedad intelectual, el papel de la medicina basada en la evidencia, la importancia de la evaluación de la calidad y los retos de la información médica de cara al futuro. Se consensuaron quince recomendaciones o conclusiones.
Abstract
Objectives: In the absence of specific legislation, the Work Group on Medicines Information of the Medicines Association of the Spanish Pharmaceutical Industry (Asociación de Medicina de la Industria Farmacéutica, AMIFE) decided to define and delimit the obligations involved in managing medicines information in the pharmaceutical industry. Although certain international guides are currently available, it was considered necessary to write a Spanish guide that could be used by pharmaceutical companies and professionals and whose demands for quality standards in the sector could also be shared with the medical community, patients and the public at large.
Methodology: In the course of one of the Group’s regular meetings, group members were invited to participate in one of the project areas, which were the planning, write-up, evaluation of experts and publication of the guide in chapters. After choosing two project coordinators, the members agreed on the subjects to be covered and established the structure for the chapters. It was decided that each chapter should include a comprehensive review of a subject and observations or conclusions that would form the basis for a series of recommendations After drafting an initial table of contents, the group invited a series of professionals to work as voluntary authors, selecting these on the basis of their experience and main field of interest. When the authors had completed the first draft of the chapters, the Group coordinators appointed two members of the group to review each chapter and check it for missing information or errors of content or form. The coordinators then reviewed the chapters themselves to ensure the consistency of the overall guide and drew up conclusions and recommendations that were reviewed by the rest of the group and voted in or out of the final document.
Results: The result was the Guía de buenas prácticas de información médica en la industria farmacéutica española. The twelve chapters comprising the guide reviewed the functions and importance of medicines information, the features and activities of the different areas of medicines information, the training and qualification frameworks of medicines information professionals, standard work procedures and the legal and ethical frameworks informing these, legislation on intellectual property rights, the importance of the role of evidence-based medicine and of quality assurance and the challenges that medicines information will have to face in the future. Fifteen conclusions or recommendations were also made at the end of the document.
1 Introducció
La indústria farmacèutica (IF), com a sector de recerca, innovació i desenvolupament, ha patit en les últimes dècades una gran transformació científica i tecnològica, en la qual continua immersa avui dia. Com a resultat d’això, s’ha hagut d’adaptar constantment i amb rapidesa a un entorn canviant i també desafiador. En aquest context, tant els professionals de la salut com els usuaris i els pacients, àvids d’informació mèdica (IM) i científica, fan servir una tecnologia cada vegada més sofisticada per buscar tot el que els pugui interessar amb relació a l’atenció de la salut i, molt especialment, al tractament de la malaltia.
La renovació tecnològica constant produeix una relació i una interacció molt ràpides en temes de salut, en les quals participen diversos actors en diferents nivells. És aquí on els departaments d’IM han exercit i exerceixen un paper fonamental en l’evolució i l’adaptació de la IF al nou entorn tecnològic (Giffin; Baumeister; Bowers, 2014). Així, els departaments d’IM tenen un paper primordial en la provisió d’informació medicocientífica objectiva i actualitzada als professionals de la salut, els pacients i els consumidors per mitjà de diversos canals de comunicació. Des de la IF, els especialistes en IM proporcionen una informació sobre els fàrmacs equilibrada i basada en l’evidència, que, moltes vegades, és un suport fonamental per als professionals de la salut en la presa de decisions terapèutiques, amb la finalitat de donar la millor atenció possible al pacient i fer un ús adequat dels fàrmacs (Fung et al., 2015).
Els departaments d’IM han evolucionat al mateix temps que ho ha fet la IF, i això ha comportat un increment en la demanda de respostes en temps real o amb uns temps de resposta molt més ràpids que abans. A més, l’ús generalitzat d’Internet (pàgines web, xarxes socials, etc.) ha incrementat el volum de consultes que reben els departaments d’IM, alhora que han canviat les característiques dels sol·licitants: d’una banda, la informació que s’ha obtingut prèviament per Internet genera consultes més complexes; de l’altra, els professionals de la salut i els pacients esperen respostes que sintonitzin en el fons i la forma amb aquesta nova realitat. Com a conseqüència d’això, la IF té un paper cada vegada més rellevant en la formació o educació dels professionals de la salut i dels pacients, per la qual cosa les empreses han de disposar de departaments d’IM dotats adequadament de recursos, que es puguin adaptar als nous mitjans i canals de comunicació i transmissió de la informació i que tinguin el suport apropiat per proporcionar informació d’una manera precisa, consistent i adequada que respongui a les demandes d’informació científica dels seus clients (Fung et al., 2016; Rojo; Fragoso, 2017).
La comunicació, la documentació i la IM en la IF han anat avançant progressivament al llarg de les últimes dècades, paral·lelament als avenços en les tecnologies de la informació. Així, des del començament dels anys vuitanta del segle passat, la IM es va convertir en una funció amb entitat pròpia, a mesura que augmentava la demanda d’informació sistemàtica i organitzada i que la complexitat de les preguntes requeria respostes més profundes i elaborades. La manera de proporcionar respostes a les consultes medicocientífiques i de comunicar la informació al consultant o usuari final s’ha transformat, i els canals més utilitzats queden molt lluny de les vies que eren habituals fins fa pocs anys. En aquest escenari, la rellevància de la funció de la IM en la IF dependrà no només de la seva adaptació a les noves tecnologies, que són canviants, sinó també de la capacitat de proporcionar valor afegit tant als clients interns (de la mateixa empresa) com externs.
Els primers departaments d’IM que van néixer en la IF responien majoritàriament a les preguntes de metges i farmacèutics sobre els productes de la companyia: composició, estabilitat, dosificació, administració, indicacions aprovades i usos fora d’indicació. Actualment, els professionals que formen part d’aquests departaments també responen consultes més complexes sobre mecanismes d’acció, farmacocinètica, farmacodinàmica, etc., i això sovint requereix una recerca addicional, més temps de resposta, professionals experts en productes o àrees terapèutiques concrets i recursos tecnològics adequats per a la gestió i l’arxivament de la IM. A més, aquest entorn nou ha permès que els professionals de la IM també es poguessin involucrar en altres tasques científiques, i d’aquesta manera han aportat valor afegit a l’activitat de l’empresa.
Actualment, les companyies disposen de sistemes d’IM que permeten fer actualitzacions ràpides i eficients i que constitueixen un punt de contacte únic per al professional de la IM dins de la IF. Aquests sistemes permeten registrar les consultes i les respostes i fer-ne el seguiment, recuperar dades, i redactar i enviar cartes i documents de resposta als consultants. Pel que fa a les consultes, es reben majoritàriament per telèfon i per correu electrònic, a través de les pàgines web corporatives i per mitjà de sistemes interns de comunicació amb la xarxa de vendes i altres departaments de l’empresa. Totes aquestes millores tecnològiques, i també la ràpida connectivitat, proporcionen als professionals de la IM una oportunitat sense precedents per ampliar el seu paper en la comunicació d’informació medicocientífica sobre seguretat i eficàcia dels fàrmacs per tal de facilitar-ne l’ús adequat (Fierro et al., 2009).
És obvi que els professionals de la salut, i també els pacients i els consumidors, disposen d’un gran nombre de mitjans per accedir a la IM i recuperar-la, sense que la informació procedeixi de la IF (per exemple, PubMed, Google, Viquipèdia, pàgines web sobre salut a Internet, etc.). Els pacients es converteixen, així, en experts en les seves pròpies malalties; però la qualitat de la informació disponible a la xarxa no sempre és contrastada i la confiança en aquests continguts és qüestionable (i pot ser, fins i tot, perillosa): informació incompleta o incorrecta, utilitzada fora de context o sense tenir en compte les característiques particulars de cada pacient. Malgrat aquest accés tan massiu a la informació, els professionals de la salut i els pacients o consumidors han continuat fent consultes mèdiques a la IF i, fins i tot, les han incrementat, i són els departaments d’IM els encarregats de respondre-les. Actualment, tal com afirmen Fierro i col·laboradors (2009), el professional de la IM ja no és un simple cercador d’informació en bases de dades que envia aquesta informació al client: ara és un professional eficient tecnològicament que filtra i analitza grans quantitats d’informació i de dades; té accés a un gran nombre de bases de dades, de llocs web i d’informes interns; compila i analitza les dades més actuals i la informació més rellevant i vàlida des del punt de vista científic, relacionada amb un fàrmac o una malaltia, fent servir, per aconseguir-ho, les últimes tecnologies; elabora documents de resposta, i adreça aquesta informació de manera eficient al client (professional de la salut, pacient, etc.) de la manera més adequada, segons cada cas (Rojo; Fragoso, 2017).
2 Deontologia professional en informació mèdica
Tota professió, i per tant tot professional, requereix un marc normatiu en el qual es pugui plasmar d’una manera pràctica l’ètica que regeix la seva activitat, i per això els col·lectius professionals senten la necessitat d’establir unes normes específiques que defineixin els drets i els deures amb què cal portar a terme la feina, amb garantia per a si mateixos i per als altres. És aquí on s’emmarca la deontologia professional que, segons la definició d’Efrén Vázquez (2011), és “el conjunto de reglas, normas, principios, presuposiciones y actitudes que regulan el ejercicio de una determinada profesión” i que sovint superen el marc del mer compliment de la llei. I són les associacions i els col·legis professionals els encarregats de plasmar aquesta reflexió ètica necessària en un conjunt normatiu que s’anomena codi deontològic, guia de bones pràctiques, codi de conducta, etc.
Si fem un repàs succint de la situació europea, va ser al començament de la dècada de 1970 quan els tècnics d’informació de la IF del Regne Unit van adquirir consciència de la necessitat d’intercanviar idees i experiències que fomentessin el seu desenvolupament professional i es van organitzar en la Pharmaceutical Information and Pharmacovigilance Association (PIPA). Aquesta associació representa avui més de vuit-cents membres, que treballen en una gran varietat de funcions de gestió de la informació en la IF, com ara la IM, la farmacovigilància, la informació de la recerca científica i la informació comercial. Un nombre creixent de membres prové de companyies de fora del Regne Unit, i també d’agències, empreses consultores i proveïdors de serveis. La primera versió de la UK guidelines for the pharmaceutical industry medical information departments (Pharmaceutical Information and Pharmacovigilance Association, 2015) va ser aprovada el 1995, i l’actualització avui dia en vigor té data del 2013. D’una gran exhaustivitat, fa un recorregut per totes les àrees, els processos, les activitats i els actors involucrats en la IM.
A Espanya, la reflexió ètica i deontològica sobre la recuperació i la difusió d’informació s’ha mogut principalment entorn de la biblioteca pública i els centres de documentació. Pel que fa a l’aparició de codis propis d’associacions professionals, l’Asociación Multisectorial de la Información (ASEDIE) va publicar el 1999 el Código ético del sector de servicios de información electrónica (Asociación Multisectorial de la Información, 2001) i el 2006 va veure la llum el Codi deontològic del Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya (Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya, 2006). Tots dos es consideren els primers instruments deontològics espanyols veritablement professionals i, com a novetat, el codi català recull per primera vegada a Espanya la creació d’una comissió deontològica dins de l’estructura del Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya.
Pel que fa a l’àmbit empresarial, el codi ètic més influent en la IF europea és sens dubte el EFPIA code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals de la European Federation of Pharmaceutical Industries and Associations (EFPIA). Aquest text comprèn la promoció de medicaments subjectes a recepta mèdica per a professionals sanitaris, i també les interaccions d’aquests professionals amb les companyies farmacèutiques. Comunament conegut com a EFPIA Health care professionals code (European Federation of Pharmaceutical Industries and Associations, 2014), exhorta els membres de l’associació no solament a complir el codi deontològic, sinó també a establir les estructures i els procediments interns necessaris per garantir-ne el compliment, la gestió de reclamacions, l’elaboració de codis nacionals, i l’elaboració d’informes anuals sobre la implantació, el desenvolupament i el compliment del codi. A més, estableix la creació d’un comitè compost per representants de les associacions nacionals, que monitorarà l’adopció dels codis locals, promourà les bones pràctiques en les activitats empresarials i ajudarà els membres a posar en pràctica els principis ètics i deontològics recollits en el text. L’última actualització (aprovada el juny del 2014) inclou un annex titulat “Guidelines for Internet websites available to healthcare professionals, patients and the public in Europe”, especialment interessant en el context actual de globalització de la informació afavorit per la generalització d’Internet.
A Espanya, l’Asociación Española de la Industria Farmacéutica (Farmaindustria) va subscriure ja el 1991 el text elaborat per l’EFPIA, i dos anys després el va adaptar a les disposicions introduïdes per la Directiva 92/28/CEE, de 31 de març de 1992, sobre medicaments d’ús humà. Des de llavors, aquesta associació empresarial ha anat analitzant, revisant i posant al dia la seva autoregulació ètica i deontològica, per tal de donar una resposta a qualsevol qüestió que es pugui presentar, i donant pautes d’actuació i regles clares i concretes que han de guiar la conducta dels laboratoris en la seva relació amb els professionals sanitaris. Així, el 2002 neix el Código de buenas prácticas de la industria farmacéutica (Farmaindustria, 2016), l’última actualització de la qual (aprovada el 2016) es fonamenta en tres àrees: la promoció de medicaments de prescripció, la interrelació amb els professionals i organitzacions sanitaris, i la interrelació amb les organitzacions de pacients.
Hi ha altres codis internacionals interessants per als professionals de la comunicació en general i per als de la IM en particular, entre els quals cal destacar el Código de conduta de la brasilera Associação da Indústria Farmacêutica de Pesquisa (Interfarma) (Associação da Indústria Farmacêutica de Pesquisa, 2016), una entitat sectorial sense ànim de lucre fundada el 1990 que representa empreses i investigadors nacionals i estrangers encarregats de la innovació en salut al Brasil. Revisat i actualitzat el 2016, es tracta d’un text dinàmic, rigorós i extremament pràctic, que té com a objectiu primordial abordar els principals aspectes dels departaments d’IM de la IF, a més d’unificar i alinear els criteris de resposta de les preguntes científiques i espontànies de la comunitat científica, per tal de permetre, així, una discussió actualitzada i no esbiaixada entre l’empresa i els professionals de la salut.
Malgrat això, de moment encara no hi ha un codi deontològic espanyol o una guia de bones pràctiques que orienti l’activitat dels serveis d’IM de la IF.
3 Guía de buenas prácticas de información médica en la industria farmacéutica española. Antecedents, justificació i mètode
L’Asociación de Medicina de la Industria Farmacéutica en España (AMIFE), fundada l’any 1975, és una agrupació de caràcter científic, sense ànim de lucre, que té com a principals objectius la formació contínua i el suport documental per a tots els que treballen en el sector medicofarmacèutic. Com a associació professional, AMIFE col·labora amb grups de treball de diverses àrees medicofarmacèutiques, en els quals acull professionals que treballen tant en el sector sanitari com en la IF. Un d’aquests grups de treball, nascut al final del 2014, és el Grupo de Información Médica.
Format actualment per prop de trenta membres procedents tant de la IF com d’empreses de serveis, aquest grup va néixer com a resposta a la necessitat de reivindicar la rellevància de les unitats d’IM de la IF a Espanya, i el seu objectiu principal és la creació d’un fòrum continu de debat sobre el futur de la IM i dels seus professionals. Altres aspectes importants de la seva tasca són l’evolució del perfil professional, el desenvolupament de les seves competències i l’anàlisi de les seves eines de treball, amb l’objectiu d’assegurar la màxima eficiència dels serveis d’IM de la indústria i el reconeixement del valor afegit que aporten en l’àmbit de la salut.
Una de les primeres qüestions que es van debatre en les reunions inicials del grup va ser la manca de legislació específica sobre IM. De fet, la IF és un dels sectors més regulats: tant a Espanya com a la resta del món, l’activitat farmacèutica està sotmesa a la intervenció administrativa de l’Estat, que supervisa i assegura unes garanties i uns mínims de qualitat en els productes adreçats als ciutadans. No obstant això, davant de l’extensa regulació a la qual s’enfronten departaments com els de farmacovigilància, registres, fabricació, etc., els serveis d’IM no tenen cap legislació exclusiva que faci referència al seu camp d’actuació, de manera que els professionals només tenen de forma gairebé exclusiva el seu criteri i la seva experiència a l’hora de crear procediments de treball i eines que assegurin la qualitat de la seva activitat.
En aquest context, el Grupo de Trabajo de Información Médica d’AMIFE va convidar tots els seus membres a participar en l’elaboració d’una guia espanyola de bones pràctiques en IM, fos en la planificació del projecte, la redacció dels textos, l’avaluació d’experts o l’edició dels capítols. A continuació, es van nomenar dos coordinadors, es van consensuar els temes dels quals calia tractar i es va establir l’estructura dels capítols, de manera que cadascun havia d’incloure una revisió exhaustiva del tema i unes observacions o conclusions que, un cop aprovades per tots els membres del grup, donarien lloc a les recomanacions finals. Després d’establir l’índex inicial (subjecte a modificacions en cas que fos necessari), es van sol·licitar voluntaris per a la redacció de la guia i, d’entre ells, es van triar els autors d’acord amb la seva experiència i el seu camp d’interès principal (per exemple, experiència en temes relacionats amb la legislació farmacèutica, interès i coneixements destacables en el camp de la propietat intel·lectual, experiència en la formació d’equips o en la redacció de procediments, etc.). Tan aviat com van estar llestes les primeres versions dels capítols, els coordinadors van designar dos membres del grup de treball per a l’avaluació d’experts de cada capítol, amb la finalitat de detectar possibles mancances dels textos o errors de contingut i de forma. Després de les correccions posteriors dels autors, els coordinadors en van fer una segona revisió, amb la finalitat d’assegurar la consistència de l’obra; a més, van extreure dels capítols les conclusions i les recomanacions, les van sotmetre a la revisió i la votació dels membres del grup de treball, i van fer l’edició final dels textos.
Així, han participat en aquest projecte quinze membres del grup, pertanyents a catorze empreses diferents. Cadascun dels capítols havia d’incloure la revisió i l’anàlisi d’un tema o aspecte específic de la professió, i també una o diverses observacions o conclusions finals que, un cop consensuades amb tots els membres del grup, donarien lloc a un nombre inicialment indeterminat de recomanacions. Tots els capítols van ser revisats per almenys quatre experts abans de ser acceptats per publicar-los (Rojo et al., 2016; Guardiola et al., 2017). El resultat d’aquest treball és la Guía de buenas prácticas de información médica en la industria farmacéutica española (Rojo; Fragoso, 2017), primera d’aquestes característiques a Espanya.
Ateses les particularitats de la informació medicocientífica que proporciona la IF, relacionada amb fàrmacs i altres productes sanitaris i adreçada als professionals de la salut i als pacients (consumidors o usuaris), es va considerar que era especialment rellevant abordar els aspectes relacionats amb l’ètica i el compliment de les normes legals i de conducta (legislació vigent, codis de conducta de la indústria farmacèutica, etc.) i aprofundir-hi. Per aquest motiu, tres dels dotze capítols de la guia es van dedicar a revisar en profunditat aquests temes: “Normativa española y europea sobre medicamentos y su aplicación a la información médica”, “Ética y deontología profesional en información médica” i “La propiedad intelectual en el ámbito de la industria farmacéutica española: aspectos relacionados con la información médica”.
Prèviament a la redacció del capítol corresponent de la guia, es va fer una revisió exhaustiva de l’ètica i la deontologia en IM des de la IF, que es va plasmar en un document previ, “Deontología profesional en información médica en la industria farmacéutica: en el camino hacia un código español de buenas prácticas” (Rojo Abril; Grupo de Trabajo de Información Médica de AMIFE, 2016).
A més, entre els dotze capítols que finalment formen la guia (taula 1) es va dedicar una atenció especial a la formació dels professionals de la IM, a la necessitat que les empreses disposin de procediments normalitzats de treball i a la gran importància de fer controls de qualitat de la informació que es proporciona.
- Información médica: su importancia en la industria farmacéutica
- Normativa española y europea sobre medicamentos y su aplicación a la información médica
- Ética y deontología profesional en información médica
- Emisores y receptores de información: industria farmacéutica, empresas de servicios, autoridades sanitarias, profesionales sanitarios, ciudadanos y pacientes
- El departamento de información médica. Qué, quién y cómo
- Procedimiento normalizado de trabajo en información médica
- Profesionales de la información médica. Formación, funciones y competencias
- Herramientas y fuentes de información médica
- Medicina basada en la evidencia. Papel de la información médica en la toma de decisiones clínicas
- La propiedad intelectual en el ámbito de la industria farmacéutica española: aspectos relacionados con la información médica
- Indicadores, métricas y gestión de la calidad de información médica
- Retos de la información médica hoy: una mirada hacia el futuro
Taula 1. Capítols de la Guía de buenas prácticas de información médica en la industria farmacéutica española (Rojo; Fragoso, 2017)
4 Guía de buenas prácticas de información médica en la industria farmacéutica española. Conclusions i recomanacions
Després del procés d’anàlisi i revisió que es va dur a terme per fer la guia, es van redactar les quinze conclusions o recomanacions següents, consensuades per a tots els participants del projecte.
- La información médica es una actividad necesaria para que los medicamentos y productos sanitarios comercializados por las compañías farmacéuticas se utilicen de forma segura y eficaz. Para ello, las empresas deben proporcionar información puntual, fiable, precisa, equilibrada e imparcial a profesionales sanitarios, pacientes y usuarios.
- A falta de legislación específica, es importante definir y orientar las obligaciones y actividades de información médica en la industria farmacéutica.
- Las asociaciones profesionales deben promover la redacción de códigos de buenas prácticas que guíen la actividad de los profesionales y garanticen la calidad, la equidad y el equilibrio de la información. Para conseguir un equilibrio entre deontología profesional y ética empresarial, se impulsará el cumplimiento de guías nacionales e internacionales actualizadas.
- Las empresas farmacéuticas deben contar con departamentos de información médica formados por equipos multidisciplinares de expertos en medicamentos y en gestión de la información.
- Las empresas farmacéuticas tienen procedimientos normalizados de trabajo que guían la actividad de los departamentos de información médica y aseguran su calidad y eficacia. Estos deben reflejar la legislación y la normativa interna de la compañía, así como las del país en el que desarrollan su actividad.
- Los técnicos de información médica desempeñan un rol estratégico que proporciona información fiable, precisa, equilibrada e imparcial sobre los productos de la compañía a profesionales de la salud, administraciones públicas y pacientes o consumidores, colaborando en el uso seguro y eficaz de los medicamentos y productos sanitarios.
- La industria farmacéutica debe apostar por la formación técnico-científica y ética de los técnicos de información médica, con el fin de seguir aportando valor añadido a sus actividades. A su vez, los profesionales deben estar comprometidos con la calidad, el desarrollo y el aprovechamiento de la formación para garantizar el mejor servicio posible.
- El profesional de la información médica debe estar siempre actualizado en el conocimiento de las herramientas de búsqueda existentes y en sus funcionalidades. Asimismo, debe estar profundamente formado en las herramientas de gestión necesarias para el desarrollo de su trabajo, con el fin de sacarles el mayor y mejor partido posible.
- Como pilar de la medicina basada en la evidencia, la información médica proporcionada por la industria farmacéutica debe ser una herramienta objetiva y rigurosa que permita al profesional sanitario la mejor toma de decisión clínica posible, junto con su experiencia y las preferencias del paciente.
- La sistemática de trabajo recomendada en información médica debe basarse en el uso del formato PICO (para la formulación de la pregunta clínica) y la metodología GRADE (para la evaluación crítica de la información). En la búsqueda y recopilación de evidencias, se aconseja utilizar fuentes secundarias y específicas para la medicina basada en la evidencia (evidencias preevaluadas).
- Para el envío de documentos científicos, es aconsejable la utilización de reproducciones digitales (antes que reprográficas). Se recomienda la firma de una licencia de reproducción (general o puntual) con una entidad de gestión autorizada (p. ej. CEDRO) o de los correspondientes contratos con las editoriales.
- Las empresas implantarán indicadores y métricas que permitan controlar y valorar la calidad del servicio de información médica. Los datos obtenidos se utilizarán además para establecer planes de mejora, prevención de riesgos, formación, etc. Las métricas deberían ser cuantitativas y cualitativas, y se aconseja repetirlas periódicamente para asegurar en el tiempo la calidad de los procesos, su eficacia, su efectividad y el cumplimiento de los estándares establecidos.
- En el contexto de libre acceso a la información, es imprescindible que la industria farmacéutica se plantee la forma adecuada de atender las demandas de los pacientes, grandes consumidores de información médica y científica y cada vez más implicados en la toma de decisiones sobre su salud.
- Se recomienda una estrecha colaboración entre los sectores público y privado, con el objetivo común de beneficiar a la salud pública en general y al paciente en particular.
- El Grupo de Trabajo de Información Médica de AMIFE recomienda a los departamentos de información médica y a sus profesionales el conocimiento y seguimiento de esta guía de buenas prácticas. Asimismo, el grupo se compromete a revisar este texto y a realizar las actualizaciones que se consideren necesarias.
Taula 2. Conclusions i recomanacions de la Guía de buenas prácticas de información médica en la industria farmacéutica española (Rojo; Fragoso, 2017)
La informació mèdica és una activitat necessària perquè els medicaments i els productes sanitaris comercialitzats per les companyies farmacèutiques es facin servir d’una manera segura i eficaç. Per aconseguir-ho, les empreses han de proporcionar informació puntual, fiable, precisa, equilibrada i imparcial als professionals sanitaris, als pacients i als usuaris.
Segons les dades extretes de l’enquesta que el 2014 va fer el Grupo de Trabajo de Información Médica d’AMIFE (Flores et al., 2015; Guardiola et al., 2016), el 62,8 % de les 85 empreses farmacèutiques i biomèdiques espanyoles que van respondre el qüestionari reben de mitjana més de 500 consultes i sol·licituds anuals d’IM. Entre les més freqüents hi ha preguntes tècniques relacionades amb l’eficàcia, la seguretat, la dosificació, l’administració i els efectes adversos dels medicaments, i també preguntes sobre possibles usos al marge de les indicacions i sobre l’estabilitat i l’emmagatzematge del producte (Flores et al., 2015; Guardiola et al., 2016) que, moltes vegades, només consten als arxius del fabricant. És evident que tots aquests temes poden repercutir directament en l’ús segur dels fàrmacs per part dels professionals sanitaris i dels pacients, i per tant és imprescindible que els departaments d’IM assegurin un nivell elevat de qualitat i de seguretat de la informació que proporcionen.
A manca d’una legislació específica, és important definir i orientar les obligacions i les activitats d’informació mèdica en la indústria farmacèutica.
A Espanya no hi ha cap llei que faci referència específica a les obligacions, les responsabilitats o les funcions dels serveis d’IM de la IF. Només es pot trobar en alguns documents l’afirmació de l’obligatorietat de l’existència d’aquest servei d’IM per als titulars d’autorització de comercialització de fàrmacs. S’especifica així en el Reial decret 1416/1994, de 25 de juny, pel qual es regula la publicitat dels medicaments d’ús humà (España, 1994). Malgrat això, a la resta del text no es fa cap referència a altres activitats que, com la IM, quedin fora del concepte de promoció.
Segons el codi de Farmaindustria (Farmaindustria, 2016), aquestes són les altres activitats no promocionals que pot dur a terme una empresa farmacèutica, algunes de les quals poden formar part, de manera total o parcial, de les responsabilitats dels departaments d’IM:
- L’etiquetatge i el prospecte dels medicaments.
- La correspondència, acompanyada, si escau, de qualsevol document no publicitari (per exemple, articles científics) necessari per respondre una pregunta concreta sobre un medicament en particular, però només si es refereix a la qüestió que és objecte de consulta i és veraç i no enganyosa.
- Les informacions concretes i els documents relatius, per exemple, al canvi d’envàs, als advertiments sobre reaccions adverses en el marc de la farmacovigilància, als catàlegs de vendes i a les llistes de preus, sempre que no hi hagi cap informació sobre el medicament. Tampoc no cobreix la informació que el metge pugui facilitar al pacient respecte a alguns medicaments determinats que, per la complexitat de la posologia, la via d’administració, etc., requereixin el lliurament d’informació addicional, i sempre que aquesta informació tingui com a objectiu millorar l’acompliment del tractament.
- La informació sobre salut humana o malalties de les persones, mentre no es faci cap referència, ni tan sols indirecta, a un medicament.
Les associacions professionals han de promoure la redacció de codis de bones pràctiques que guiïn l’activitat dels professionals i garanteixin la qualitat, l’equitat i l’equilibri de la informació. Per aconseguir un equilibri entre deontologia professional i ètica empresarial, s’impulsarà el compliment de guies nacionals i internacionals actualitzades:
- Código de buenas prácticas de la industria Farmacéutica de Farmaindustria (Farmaindustria, 2016).
- UK Guidelines for the Pharmaceutical Industry Medical Information Departments (Guia de bones pràctiques de la PIPA): és un conjunt de normes accessibles i indicatives d’un nivell de qualitat elevat en els serveis d’informació mèdica de les empreses farmacèutiques (Pharmaceutical Information and Pharmacovigilance Association, 2015).
- Código de conducta para mediadores de información de la European Association of Information Services (EUSIDIC): recull exhaustivament els aspectes empresarials de les activitats relacionades amb la informació científica (European Association of Information Services, 1994).
Les empreses farmacèutiques han de tenir departaments d’informació mèdica formats per equips multidisciplinaris d’experts en medicaments i en gestió de la informació.
El departament d’IM és el que s’encarrega de subministrar informació precisa, actualitzada i equilibrada sobre els medicaments de la companyia en resposta a peticions espontànies dels professionals sanitaris, els pacients i altres àrees de la companyia, com ara el departament mèdic, vendes, màrqueting, farmacovigilància, registres, qualitat, o recerca i desenvolupament. Per a molts metges, farmacèutics i altres professionals sanitaris, aquest és el primer punt de contacte quan necessiten informació sobre els productes d’una companyia; a més, aquesta informació pot ser urgent i complexa, i fins i tot pot ser la base per a la gestió del tractament d’un pacient. Aquesta és la raó per la qual el professional de la IM ha de tenir, a més de coneixements sobre els productes, habilitats per gestionar amb professionalitat les respostes als usuaris.
Les empreses farmacèutiques tenen procediments normalitzats de treball que guien l’activitat dels departaments d’informació mèdica i n’asseguren la qualitat i l’eficàcia. Aquests procediments han de reflectir la legislació i la normativa interna de la companyia, i també les del país on porten a terme l’activitat.
Com qualsevol altra activitat d’una empresa farmacèutica, el servei d’IM ha de complir alguns paràmetres de qualitat, estandardització i transparència, de manera que la informació que es doni sigui precisa, fiable, equilibrada i consistent. Per fer-ho, disposa de procediments normalitzats de treball: documents que recullen d’una manera detallada, exhaustiva, precisa i sense cap possibilitat de confusió l’estructura, l’organització i la metodologia del servei d’una manera clara i concisa, i descriuen pas a pas la feina diària. Aquests procediments normalitzats de treball es redacten d’acord amb les lleis i els estàndards nacionals i internacionals, i recolzen en els principis i els valors corporatius que es recullen en les polítiques de cada companyia. Són, a més, documents vius, revisables i subjectes a modificacions segons les necessitats corporatives.
Per la seva banda, les empreses de serveis independents que treballen per a la IF elaboren els seus propis procediments, en els quals detallen la seva tasca diària d’acord amb la normativa local i europea i, normalment, també amb les polítiques de les companyies a les quals donen el servei d’IM.
Els tècnics d’informació mèdica exerceixen un rol estratègic que proporciona informació fiable, precisa, equilibrada i imparcial sobre els productes de la companyia a professionals de la salut, administracions públiques i pacients o consumidors, col·laborant en l’ús segur i eficaç dels medicaments i els productes sanitaris.
El servei d’IM és un servei orientat al client que ajuda a millorar l’ús segur i eficaç dels productes de la companyia. Així, la funció principal dels tècnics d’informació mèdica és proporcionar informació basada en l’evidència d’una manera puntual, precisa i imparcial als professionals de la salut, als consumidors o als pacients, per assegurar l’ús apropiat dels productes de la companyia. D’altra banda, es revelen com un rol estratègic i una gran font d’informació per a la companyia, ja que poden proporcionar dades o consideracions importants sobre el client que es poden incorporar als plans del cicle del producte i altres activitats rellevants.
Segons les dades extretes de l’enquesta que hem esmentat del grup de treball d’AMIFE (Flores et al., 2015; Guardiola et al., 2016), entre les seves principals activitats hi ha la gestió de consultes d’informació sobre medicaments, l’elaboració de respostes estàndard, la realització de cerques bibliogràfiques, i el desenvolupament i el manteniment de coneixements científics actualitzats sobre productes de la companyia i àrees terapèutiques rellevants.
La indústria farmacèutica ha d’apostar per la formació tecnicocientífica i ètica dels tècnics d’informació mèdica, amb la finalitat de continuar aportant valor afegit a les seves activitats. Al seu torn, els professionals han d’estar compromesos amb la qualitat, el desenvolupament i l’aprofitament de la formació per garantir el millor servei possible.
Atès el gran nombre de competències científiques, analítiques, ètiques, tècniques i comunicatives que els tècnics d’informació mèdica han d’exercir per acomplir de manera adequada la seva tasca, és fonamental que les empreses disposin d’un programa d’educació contínua que vagi més enllà dels continguts concrets de la IM. Entre les àrees de formació més importants cal destacar no solament les que es relacionen amb els medicaments, els productes sanitaris i les àrees terapèutiques pròpies del negoci i de la seva àrea d’especialització, sinó també altres competències referides a l’ètica professional i empresarial, la gestió d’equips, la planificació estratègica, la relació amb el client, etc.
Per la seva banda, els professionals de la IM han de posar el màxim interès en l’aprofitament d’aquesta formació, ja que se’n deriven el perfeccionament constant de la seva activitat laboral i el manteniment del seu compromís amb la seva empresa, amb els professionals sanitaris i amb els pacients que, en última instància, es beneficien dels serveis d’IM de la IF.
El professional de la informació mèdica ha d’estar sempre actualitzat pel que fa al coneixement de les eines de cerca existents i les seves funcions. Així mateix, ha d’estar profundament format en les eines de gestió necessàries per a l’exercici de la seva feina, amb la finalitat de treure’n el partit més gran i més bo possible.
Des del naixement d’Internet en els anys setanta del segle passat, però sobretot en les últimes dècades, la feina diària dels professionals de la IM ha estat profundament modificada per les noves tecnologies, pel creixement exponencial de la informació cientificotècnica disponible i per l’existència d’una quantitat de fonts i eines pràcticament inabastable. Per la seva banda, aquestes eines han evolucionat considerablement i s’han convertit en més amigables i fàcils d’utilitzar. Malgrat això, per fer una cerca realment eficaç es requereixen uns coneixements i una experiència que, en molts casos, només els tècnics d’informació mèdica han adquirit al llarg d’anys de treball i de formació específica.
Com hem comentat abans, l’objectiu últim del tècnic d’informació mèdica és proporcionar una informació objectiva i de qualitat tant als professionals sanitaris com als pacients; per fer-ho, ha d’utilitzar totes les eines que té al seu abast. El tècnic d’informació mèdica no tan sols ha de conèixer els instruments tècnics propis de la seva activitat i ha de saber treure’n el màxim profit, sinó que s’ha d’actualitzar contínuament respecte a les novetats que puguin aparèixer. A més, no solament és important que sàpiga manejar les fonts d’informació, sinó que ha de tenir la capacitat crítica adequada per poder valorar la informació que recupera i que, finalment, subministra.
Com a puntal de la medicina basada en l’evidència, la informació mèdica que proporciona la indústria farmacèutica ha de ser una eina objectiva i rigorosa que permeti al professional sanitari prendre la millor decisió clínica possible, juntament amb la seva experiència i les preferències del pacient.
La medicina basada en l’evidència consisteix en la presa de decisions per resoldre problemes clínics de pacients individuals, tenint en compte no tan sols l’avaluació sistemàtica de les millors evidències actuals, sinó també l’experiència del clínic i les preferències del mateix pacient. Així, la medicina basada en l’evidència utilitzada d’una manera correcta no s’ha de reduir només a la lectura de publicacions i evidències en revistes biomèdiques, sinó que s’ha d’enfocar en els principals objectius que té i en la seva motivació més important: la millora de la qualitat de l’atenció sanitària, en el sentit de la cerca d’intervencions i pràctiques que funcionen, i també l’eliminació de les que són ineficaces o perjudicials per al pacient.
Un dels punts clau de la medicina basada en l’evidència és l’actualització de les evidències: la pràctica que avui es considera que és la millor pot canviar o, fins i tot, pot ser rebutjada el mes o l’any següent, i això obliga a fer la tasca àrdua però necessària de mantenir-se al dia. Per facilitar aquesta actualització, el professional sanitari té a la seva disposició diverses eines i fonts d’informació, entre les quals els departaments d’IM de la IF són un proveïdor important d’evidències científiques externes, un dels puntals de la medicina basada en l’evidència per a la presa de decisions clíniques.
La sistemàtica de treball recomanada en informació mèdica s’ha de basar en l’ús del format PICO (per a la formulació de la pregunta clínica) i en la metodologia GRADE (per a l’avaluació crítica de la informació). En la cerca i la recopilació d’evidències, s’aconsella fer servir fonts secundàries i específiques per a la medicina basada en l’evidència (evidències preavaluades).
Una de les eines més utilitzades a l’hora d’aplicar la medicina basada en l’evidència en la pràctica clínica és l’anomenada metodologia dels cinc passos (Sackett et al., 2000): formulació de la pregunta clínica, cerca de la millor evidència, avaluació crítica de l’evidència, aplicació de l’evidència als pacients i autoavaluació (figura 1):
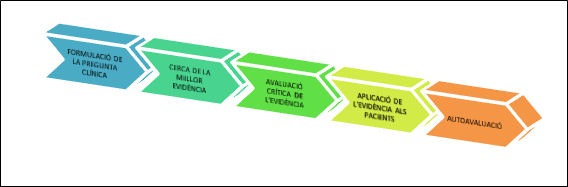
Figura 1: Esquema dels cinc passos en la medicina basada en l’evidència
Les preguntes es generen per qüestions clíniques i generalment estan relacionades amb el diagnòstic, l’etiologia, el pronòstic, el tractament o la prevenció.
Una pregunta ben construïda hauria de tenir quatre components que s’identifiquen amb l’acrònim PICO:
- P (population): pacient o grup de pacients amb una condició o malaltia concreta (determina les característiques del pacient per delimitar la cerca).
- I (intervention): intervenció que és objecte de la pregunta (terapèutica, preventiva, diagnòstica o pronòstica).
- C (comparison): intervenció alternativa comparativa, si està disponible.
- O (outcome): resultat esperat o conseqüències de la intervenció d’interès.
Mentre que les fonts primàries són, sobretot, publicacions procedents de revistes biomèdiques recopilades per cercadors i bases de dades bibliogràfiques, les fonts secundàries contenen informació “prefiltrada” o “preavaluada”, que facilita la recuperació d’evidències. Entre aquestes, cal destacar les metaanàlisis, les revisions sistemàtiques, les guies de pràctica clínica i els informes d’avaluació de tecnologies (Health Technology Assessment – HTA). Alguns d’aquests documents estan enfocats específicament a l’obtenció d’informació per a l’aplicació de la metodologia de la medicina basada en l’evidència.
Per a la tramesa de documents científics, és aconsellable fer servir reproduccions digitals (abans que reprogràfiques). Es recomana signar una llicència de reproducció (general o puntual) amb una entitat de gestió autoritzada (p. ex., CEDRO) o signar els contractes corresponents amb les editorials.
Tenint en compte l’evolució tecnològica i l’arribada massiva dels formats digitals, l’ús de fotocòpies de llibres i revistes ha deixat de ser útil i eficient tant en la IM com en el món de la informació i la documentació en general. A més, el format digital permet l’emmagatzematge massiu i facilita l’accés ràpid a la informació, a més de la possibilitat de fer-ne un ús gairebé immediat i d’aplicar-la ràpidament a la pràctica clínica si cal.
Com no podia ser altrament, la informació que fan servir diàriament els tècnics d’informació mèdica està subjecta a la legislació nacional i internacional sobre propietat intel·lectual, que detalla què es pot fer i què no es pot fer amb una obra, en quines condicions concretes es pot fer servir i quines compensacions han de rebre, si escau, els propietaris dels drets d’autor i d’explotació d’una obra literària, artística o científica. Tenint en compte la complexitat i el detall de la llei, i com que el temps és un factor clau en la qualitat del seu servei, és important que els departaments d’IM disposin de l’ajuda d’entitats especialitzades i facultades per gestionar els drets d’autor.
A Espanya, actualment hi ha vuit entitats de gestió autoritzades pel Ministerio de Educación, Cultura y Deporte que representen diferents grups de propietaris dels drets: autors i editors, artistes plàstics i audiovisuals, artistes, etc. Pel que fa als drets relacionats amb la IM, el Centro Español de Derechos Reprográficos (CEDRO) representa autors i editors d’obres de text (llibres, publicacions periòdiques, partitures musicals), i el seu repertori està format per les obres d’autors i editors d’àmbit nacional i internacional, amb convenis amb més de trenta entitats homòlogues estrangeres. En aquest sentit, CEDRO ofereix als laboratoris farmacèutics solucions per a l’ús de continguts protegits per drets d’autor, i amb això possibilita que es puguin utilitzar per respondre les consultes que reben de professionals sanitaris sobre els seus productes. Aquesta llicència proporciona als laboratoris farmacèutics flexibilitat, agilitat en el desenvolupament de les activitats d’IM i, sobretot, el reconeixement dels clients, perquè ofereix garanties de respecte al dret dels autors i a la legislació vigent en matèria de copyright.
Les empreses implantaran indicadors i mètriques que permetin controlar i valorar la qualitat del servei d’informació mèdica. Les dades que s’obtinguin es faran servir, a més, per establir plans de millora, de prevenció de riscos, de formació, etc. Les mètriques haurien de ser quantitatives i qualitatives, i s’aconsella repetir-les periòdicament per assegurar en el temps la qualitat, l’eficàcia i l’efectivitat dels processos i el compliment dels estàndards establerts.
Garantir la qualitat d’un producte o servei per contribuir al seu èxit comporta la implantació de sistemes de gestió de qualitat. Aquesta gestió implica una doble aproximació: d’una banda, l’aplicació de mesures adreçades a assegurar la qualitat (assegurament per mitjà de la implantació d’estàndards de qualitat) i, de l’altra, l’aplicació de mesures adreçades a controlar aquesta qualitat (control del servei prestat mitjançant auditories internes i externes).
Els tècnics d’informació mèdica de la IF són responsables del desenvolupament i la implantació de mètriques quantitatives i qualitatives que permetin obtenir estadístiques de la càrrega de treball i de la qualitat de les activitats que duen a terme (nombre de consultes respostes, temps de respostes, satisfacció del client, etc.). A més, aquestes mètriques es poden utilitzar internament en les empreses per detectar necessitats de formació o ajustos de personal, percepcions sobre clients i autoritats, indicadors de rendiment de l’estratègia corporativa, etc.
En el context d’accés lliure a la informació, és imprescindible que la indústria farmacèutica es plantegi la manera adequada d’atendre les peticions dels pacients, grans consumidors d’informació mèdica i científica i cada vegada més implicats en la presa de decisions sobre la seva salut.
Entre els reptes diversos als quals s’enfronta la IM de la IF, la informació als pacients és un dels que genera més debat, tant en les mateixes empreses com en l’àmbit general de l’opinió pública.
Segons la legislació actual, a un pacient que sol·liciti informació a una empresa farmacèutica se l’ha d’adreçar al seu metge, que podria contactar amb el servei d’IM per rebre els detalls amb els quals després haurà d’informar el seu pacient. A la pràctica, però, aquest cercle no se sol tancar, i per aquest motiu l’empresa que comercialitza un fàrmac no té l’oportunitat de compartir amb el pacient, encara que sigui de manera indirecta, informació que podria ser rellevant durant el consum o l’ús d’un determinat medicament o producte farmacèutic. A més, la immediatesa que pot requerir aquest tipus de consultes (relacionades amb l’administració o la dosificació dels fàrmacs, amb el funcionament dels dispositius, etc.) fa que la comunicació no sempre sigui efectiva en condicions reals. Malgrat això, els mitjans tecnològics actuals ens poden permetre establir canals eficaços per fer realitat aquest flux; així, doncs, el repte que es planteja és establir els mitjans humans i tecnològics adequats, amb la col·laboració de les administracions sanitàries.
D’altra banda, les associacions de pacients demanen activament a les empreses farmacèutiques informació per als associats, ja que tenen un paper actiu en el foment de la recerca i de l’educació sanitària. Els departaments d’IM podrien contribuir a satisfer aquesta demanda, assegurant l’establiment dels límits entre informació i promoció —a Espanya està prohibida la promoció directa als pacients de fàrmacs de prescripció— i facilitant els canals adequats per a la transmissió d’aquesta informació.
El pacient demana tenir cada vegada més control sobre les decisions relatives a la seva salut i per tenir-ne necessita estar informat. En aquest entorn, les autoritats sanitàries han de reflexionar sobre els límits de la informació als pacients, alhora que la IF ha d’iniciar el debat sobre la seva obligació legal i moral de proporcionar al pacient una informació objectiva, equilibrada i no promocional sobre els medicaments i els productes sanitaris.
Es recomana una col·laboració estreta entre els sectors públic i privat, amb l’objectiu comú de beneficiar la salut pública en general i el pacient en particular.
Els serveis d’IM s’enfronten a reptes nombrosos i complexos. Aquesta situació no és nova ni exclusiva, però està a les mans dels professionals el fet d’acceptar aquests reptes i convertir-los en oportunitats per créixer i millorar. El gran objectiu és centrar els esforços a proporcionar respostes de qualitat que contribueixin a un ús eficaç i segur dels productes sanitaris, mitjançant els canals i en el format preferit pels usuaris.
Tal com en altres sectors industrials i empresarials, la col·laboració en IM entre l’Administració, la indústria i altres entitats com la universitat redundaria, sens dubte, en el benefici a curt, mitjà i llarg termini de la salut dels pacients en particular i del sistema de salut en general. Està a les mans de tots poder establir les bases d’aquesta col·laboració i posar-la en pràctica.
El Grupo de Trabajo de Información Médica d’AMIFE recomana als departaments d’informació mèdica i als seus professionals conèixer i seguir aquesta guia de bones pràctiques. De la mateixa manera, el grup es compromet a revisar aquest text i a fer-ne les actualitzacions que calguin.
El Grupo de Trabajo de Información Médica d’AMIFE considera que la Guía de buenas prácticas, és un instrument que pot ser adequat per utilitzar-lo com a referència en els departaments d’IM i per als seus professionals. Per aquest motiu, aconsella que les persones que estiguin involucrades en la IM des de la IF en coneguin el contingut. Igualment, i tenint en compte els canvis continus que es produeixen en aquesta àrea, aquest grup es compromet a revisar i actualitzar el text, de manera total o parcial, quan calgui, amb la finalitat que aquesta guia continuï sent útil tant actualment com en el futur.
Bibliografia
Asociación Multisectorial de la Información (2001). “Código ético del sector de servicios de información electrónica”. En: Domínguez Sánchez, Pilar; García de Paso, Esperanza (coord.). “Códigos de ética y deontología profesional. Selección, traducción y edición crítica”. Boletín de la ANABAD, vol. 51, n.º 3, p. 135–145.
Associação da Indústria Farmacêutica de Pesquisa (2016). Código de conduta Interfarma. Revisão 2016. São Paulo, Brasil: Interfarma. <https://www.interfarma.org.br/public/files/biblioteca/105-codigoconduta2016bilinguesite.pdf>. [Consulta: 23/06/2017].
Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya (2006). Codi deontològic del Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya. Barcelona: Col·legi Oficial de Bibliotecaris-Documentalistes de Catalunya.
<http://www.cobdc.org/collegi/codi_deontologic.html>. [Consulta: 23/06/2017].
España (1994). “Real decreto 1416/1994, de 25 de junio, por el que se regula la publicidad de los medicamentos de uso humano”. Boletín oficial del Estado, n.º 180 (29/07/1994), p. 24.404–24.410.
<https://www.boe.es/boe/dias/1994/07/29/pdfs/A24404-24410.pdf>. [Consulta: 23/06/2017].
European Association of Information Services (EUSIDIC) (1994). Código de conducta para mediadores de información. Madrid: Centro de Información y Documentación Científica (CINDOC), Doc6. <http://digital.csic.es/bitstream/10261/36897/1/CodigoDeontologico.pdf>. [Consulta: 02/12/2017].
European Federation of Pharmaceutical Industries and Associations (2014). EFPIA code on the promotion of prescription-only medicines to, and interactions with, healthcare professionals. Final consolidated version 2013. Brussels: EFPIA. <http://transparency.efpia.eu/uploads/Modules/Documents/efpia-hcp-code-2014.pdf>. [Consulta: 23/06/2017].
Farmaindustria (2016). Código de buenas prácticas de la industria farmacéutica. Madrid: Farmaindustria.
<http://www.farmaindustria.es/web/wp-content/uploads/sites/2/2014/06/CBP_WEB_ESP.pdf>. [Consulta: 23/06/2017].
Fierro, Lesley; Savulich, Donna; Fraser, Charles; Gažo, Andrew; Wyble, Christine (2009). “Historical perspective of technologies used in medical communications. Past, present, and future”. Drug information journal, vol. 43, p. 705–712.
Flores, Ángeles; Balmy, Sylvaine; Rojo, Mónica; Ortega, Patricia; Cabo, Lurdes; Carboneras, M.; del Cano, Marta; Escudero, Nuria; Fragoso, Jaime; García-Ortiz, Daniel; Iglesias, Inmaculada; Pozo, Tamara; Pulido, Fernanda; Rodríguez, Mónica; Sánchez-Navarro, María José; MI Working Group AMIFE (2015). “Descriptive
analysis of medical information departments within the pharmaceutical industry in Spain”. European medical information and communications conference. London, 10–11 November 2015.
Fung, Stancey M.; Chang, Dannis Y.; Patel-Romero, Roshni; Suchodolski, Matt (2016). “Survey of health care practitioners’ preferences for medical information: collective insights for impacting patient care”. Therapeutic innovation & regulatory science, vol. 50, no. 5, p. 569–576.
Giffin, Suzana A.; Baumeister, Peter; Bowers, David (2014). “Review of the evolution of medical information in light of changes in the external landscape”. Therapeutic innovation & regulatory science, vol. 48, no. 6, p. NP6–NP14.
Guardiola, Elena; Flores, Ángeles; Balmy, Sylvaine; Rojo, Mónica; Ortega, Patricia; Cabo, Lurdes; del Cano, Marta; Escudero, Nuria; Fragoso, Jaime; García-Ortiz, Daniel; Iglesias, Inmaculada; Pozo, Tamara; Pulido, Fernanda; Rodríguez-Sangrador, Mónica; Sánchez-Navarro, María-José, on behalf of the AMIFE MI Working Group (2016). “Structure, organization and functions of medical information departments within the pharmaceutical industry in Spain: Results of a survey”. 15th European Association for Health Information and Libraries (EAHIL) conference. Sevilla, 6–11 de junio de 2016. <https://www.researchgate.net/publication/305402990_Structure_organization_and_functions_of_Medical_
Information_departments_within_the_pharmaceutical_industry_in_spain_Results_of_a_survey>. [Consulta: 29/11/2017].
Guardiola, Elena; Fragoso, Jaime; Rojo, Mónica; Balmy, Sylvaine; Cabo, Lurdes; Díaz, Lourdes; Escudero, Nuria; Flores, Ángeles; García-Ortiz, Daniel; Hernández, M. Ángeles; Iglesias, Inmaculada; Ortega, Patricia; Pozo, Tamara; Pulido, Fernanda; Zabena, Carina; Grupo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica en España [AMIFE] (2017). “Elaboració de la primera Guia de Bones Pràctiques d’Informació Mèdica a la Indústria Farmacèutica Espanyola”. ii Jornades de biblioteques i salut de Catalunya BCSalut 2017. Barcelona, 8 i 9 de juny de 2017. <https://scientiasalut.gencat.cat/handle/11351/2968>. [Consulta: 29/11/2017].
Medical Information Group (2015). Guide on medical information. São Paulo: Interfarma Associação da Indústria Farmacêutica de Pesquisa. <https://www.interfarma.org.br/public/files/biblioteca/72-guide-on-medical-information-site.pdf>. [Consulta: 23/06/2017].
Pharmaceutical Information and Pharmacovigilance Association (2015). UK guidelines for the pharmaceutical industry medical information departments. Haslemere, Surrey: PIPA. <http://www.pipaonline.org>. [Consulta: 10/05/2016].
Rojo, Mónica; Grupo de Trabajo de Información Médica de la Asociación de Medicina de la Industria Farmacéutica [AMIFE] (2016). “Deontología profesional en información médica en la industria farmacéutica: en el camino hacia un código español de buenas prácticas”. Métodos de información, vol. 7, n.º 12, p. 43–68. <http://www.metodosdeinformacion.es/mei/index.php/mei/article/view/IIMEI7-N12-043068/902>. [Consulta: 29/11/2017].
Rojo, Mónica; Fragoso, Jaime (ed.) (2017). Guía de buenas prácticas de información médica en la industria farmacéutica española. Madrid: AMIFE. [En premsa].
Rojo, Mónica; Fragoso, Jaime; Balmy, Sylvaine; Cabo, Lurdes; del Cano, Marta; Díaz, Lourdes; Escudero, Nuria; Flores, Ángeles; García-Ortiz, Daniel; Guardiola, Elena; Iglesias, Inmaculada; López, Ana María; Martínez, Aitor; Ortega, Patricia; Pozo, Tamara; Pulido, Fernanda; Sánchez-Navarro, M. José; Zabena, Carina; del Foro de Información Médica de la Industria Farmacéutica (2016). “Primera guía española de buenas prácticas de información médica en la industria farmacéutica. Experiencia de trabajo”. XII Jornadas APDIS. Investigação, inovação, intervenção. Coimbra, 20–22 de abril de 2016.
Sackett, David L.; Straus, Sharon E.; Richardson, W. Scott; Rosenberg, William; Haynes, R. Brian (2000). Evidence-based medicine: how to practice and teach EBM. (2nd ed.). Edinburgh: Churchill-Livingstone.
Vázquez, Efrén (2011). “Reflexiones sobre deontología judicial”. En: Campos, F. G.; Cienfuegos, D.; Rodríguez, L. G.; Zaragoza, J. (coord.). Entre libertad y castigo: dilemas del estado contemporáneo. México D. F.: Universidad Nacional Autónoma de México, p. 837–843. <http://biblio.juridicas.unam.mx/libros/7/3104/50.pdf>. [Consulta: 23/06/2017].

 Llicència Creative Commons de tipus
Llicència Creative Commons de tipus